Определение растворимых углеводов фотометрически с пикриновой кислотой
пропорциональна количеству углеводов в реакции, поэтому возможно их колориметрическое определение.
Используют реакцию восстановления пикриновой кислоты (2,4,6-тринитрофенола) в пикрамииовую.
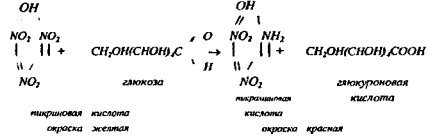
Таким методом можно определять глюкозу, фруктозу, маннозу, галактозу, ксилозу, арабинозу. Дисахариды * сахароза, целлобиоза, лактоза, мальтоза - определяются после кислотного гидролиза; определение крахмала и некоторых других полисахаридов можно проводить после слабого кислотного гидролиза. Ход работы. Для экстракции растворимых углеводов взять навеску 0.1- 5+0.0001 г воздушно-сухого растительного материала. Перенести в стакан емкостью 100 мл и залить 50 мл дистиллированной воды. Содержимое стакана тщательно перемешать стеклянной лапочкой и поставить в водяную баню. Если материал не содержит крахмапа, то экстракцию углеводов ведут в течение 30 мин при 70°С. При наличии крахмала (зерно, клубни) экстракцию ведут при 40 - 50°С в течение 1 часа. После экстракции углеводов провести в растворе осаждение белков. Полного осаждения белков для определения углеводов не требуется, но необходимо, чтобы раствор не содержал опалисцируюших компонентов. Для этого при анализе зерна и зеленых частей растений в стакан с экстрактом углеводов прилить 0.7 мл 10 %- го уксуснокислого свинца, при анализе корнеклубнеплодов - 0.3 - 0.4 мл 10%-го уксуснокислого свинца, тщательно перемешать и оставить на 20 мин. для созревания осадка. Профильтровать раствор через сухой фильтр средней плотности в мерную колбу на 100 мл, можно фильтровать в колбы на 200 мл, если ожидается высокое содержание углеводов.
Определение моносахаридов.
В сухие химические пробирки емкостью 20 - 40 мл берут микропипеткой 1-3 мл фильтрата, содержащего от 0.2 до 0.3 мг редуцирующих сахаров. Если количество фильтрата менее 3 мл, то до этого объема доводят дистиллированной водой. В пробирку прилить 3 мл пикриновой кислоты и 3 мл 20%- го раствора соды (соотношение компонентов 1:1:1), закрыть пробкой, тщательно перемешать. Открыть пробку и поставить пробирку в кипящую водяную баню на 30 мин. Уровень воды должен быть не ниже 2/3 высоты объема смеси в пробирках. Для установки пробирок в баню использовать пластмассовый или металлический штатив. Через 30 мин пробирки вынимают и охлаждают. Затем содержимое пробирок через воронку без фильтра переносят в мерные колбы на 50 мл, ополаскивая несколько раз пробирки дистиллированной водой. Содержимое колбочек доводят до метки дистиллированной водой, раствор перемешивают и колориметрируют при 490 нм.Холостое определение проводят одновременно. В стакан на 100 мл приливают 50 мл дистиллированной воды, добавляют в него 0.7 мл уксуснокислого свинца. Содержимое стакана переносят в мерную колбу на 100 мл, доводят до метки. Из колбы берут 3 мл раствора в пробирку, прибавляют 3 мл пикриновой кислоты и 3 мл 20%-го раствора соды, перемешивают, выдерживают 30 мин в кипящей водяной бане. Охлаждают и переносят в мерную колбу на 50 мл.
Раствор, полученный таким образом, используют как раствор сравнения при колор им етрировани и. Расчет.
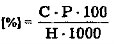 Содержание моносахаридов
Содержание моносахаридов
где: С - количество глюкозы по графику, мг; Р - разведение (100/3); Н - навеска воздушно-сухого материала, г. Определение суммы сахаров. В сухие пробирки микропипеткой взять по 1 мл фильтрата и прибавить 0.5 мл 10 %-го раствора НС1. Поставить штативы в кипящую водяную баню на 5 мин. для гидролиза дисахаров. После гидролиза содержимое пробирок охладить, прибавить 5 мл 20 %-го раствора соды для нейтрализации соляной кислоты.
Добавить в пробирку 3 мп пикриновой кислоты, перемешать, прилить 3 мл 20 %-го раствора соды, тщательно перемешать.
Поставить пробирку в кипящую водяную баню на 30 мин., охладить. Через воронку без фильтра перенести в мерную колбу на 50 мл. Провести колориметрическое определение моно-сахаридов.Сумма сахаров рассчитывается по формуле приведенной
выше.
Количество дисахаров определяется по разнице: дисахара % = (% сахаров -% моносахаров) • 0.95 (0.95 - коэффициент пересчета глюкозы в дисахара). Приготовление шкалы стандартных растворов
1 г просушенной в течении 2 часов при температуре 60-70° С глюкозы растворяем в 1 л дистиллированной воды. Для построения графика набирают в пробирки 0.2; 0.4; 0.6; 0.8; 1.0; 1.2; 1.4; 1.6; 1.8; 2.0; 2.2; 2.4; 2.6 мл стандартного раствора, доводят до 3 мл водой и далее поступают так же, как и в случае определения моносахаридов. При построении графика и при определении углеводов сравнение ведут по раствору, содержащему все реактивы, прибавляемые к 3 мл воды. type="1"> Приготовление реактивов. Насыщенный раствор пикриновой кислоты: 20-30 г пикриновой кислоты заливают примерно 500 мл воды. Тщательно перемешивают в течение 5-10 мин. Для работы из этого объема отфильтровывают необходимое количество надосадочной жидкости, а в исходный раствор периодически доливают воды до тех пор, пока на дне есть осадок. Раствор в склянке из темного стекла может храниться неопределенно долго. 20 %-ный раствор соды (NajCO}). После растворения соды раствор необходимо профильтровать. 200 г соды растворяют в 800 мл дистиллированной воды.
3.10 %-ный раствор ПС/. 236.8 мл конц. НС/ (плотность - 1.19) вливают в 1 л мерную колбу, предварительно налив туда 500 мл воды, доводят до метки.
Еще по теме Определение растворимых углеводов фотометрически с пикриновой кислотой:
- ФОСФОРНЫЕ УДОБРЕНИЯ, СОДЕРЖАЩИЕ ФОСФОРНЫЕ СОЕДИНЕНИЯ, НЕРАСТВОРИМЫЕ В ВОДЕ, НО РАСТВОРИМЫЕ В СЛАБЫХ КИСЛОТАХ
- Определение молочной кислоты по реакции с параоксидифени- лом.
- Определение сиаловых кислот в сыворотке крови по реакции с резорцином.
- Определение пировиноградной кислоты по модифицированному методу Фреедмана и Хаугена.
- ОПРЕДЕЛЕНИЕ ОБЩЕГО КОЛИЧЕСТВА ЛЕТУЧИХ ЖИРНЫХ КИСЛОТ (ЛЖК)
- Определение мочевой кислоты в сыворотке крови по реакции с фосфорно-вольфрамовым реактивом.
- Определение мочевой кислоты в сыворотке крови животных с использованием заводского набора реактивов.
- Определение диеновых конъюгатов и кетодиенов полиненасы- щениых жирных кислот в крови.
- Определение содержания неэтерифицированных жирных кислот (НЭЖК) в сыворотке (плазме) крови (по Лауреллу и Тибблингу).
- ЗНАЧЕНИЕ РАСТВОРИМОСТИ СОЕДИНЕНИЙ
- Создание теорий химического строения, жиров, углеводов и белков
- РОЛЬ КАЛИЯ В УСВОЕНИИ АММИАКА И В ОБРАЗОВАНИИ АКТИВНЫХ ФОРМ УГЛЕВОДОВ В РАСТЕНИИ [21]
- Никотиновая кислота (витамин В5).
- ОТРАВЛЕНИЕ СИНИЛЬНОЙ КИСЛОТОЙ
- Свойства гуминовых кислот
- Производные хлорфеноксиуксусной и хлорфеноксипропионовой кислот
- Турбидиметрический метод с сульфасалициловой кислотой.
- Взаимодействие токсикантов с нуклеиновыми кислотами.
- Производные карбаминовой, тио- и дитиокарбаминовой кислот
- ХРОМАТОГРАФИЧЕСКИЙ АНАЛИЗ ЛЕТУЧИХ ЖИРНЫХ КИСЛОТ