Эфирная модель строения атома
В 1911 г. Э. Резерфорд предложил ядерную модель атома, которая в миниатюре напоминает Солнечную систему.
Поэтому она стала называться планетарной моделью атома. Данная модель строится на основе следующих основных положений. Атом состоит из положительно заряженного ядра и окружающей его электронной оболочки. В ядре сосредоточена практически вся масса атома. Суммарный положительный заряд ядра равен суммарному отрицательному заряду электронов. Атом в целом нейтрален. Электроны движутся вокруг ядра по орбитам под действием ку- лоновских сил.
Первые два положения следуют из результатов лабораторных йссле- дований Резерфорда, Моли, Борна и других физиков, и они составляют основу любой модели строения атома. Третье положение основывается на логических выводах, не подтвержденными результатами лабораторных исследований. Поэтому все существующие модели строения атома различаются, в основном, строением электронной оболочки.
С квантово-механической точки зрения классическое представление об орбите в планетарной модели, как траектории движения электрона вокруг ядра атома, не выдерживает критики. Скорость электрона на круговой орбите с радиусом г к 10-1° м должна быть порядка v ~ IO6 м, а центростремительное ускорение (а = V2Ix) порядка IO22 м/с2. Такой ускоренно движущийся электрон должен непрерывно излучать электромагнитные волны и, соответственно, терять энергию, что приведет к его падению на ядро [57]. Поэтому, если электроны действительно движутся по орбитам вокруг ядра, то должны наблюдаться неустойчивость атомов и существование только непрерывного спектра излучений, т.е. спектральных линий не должно быть. Однако в действительности наблюдаются и устойчивость атома, и линейчатый спектр излучений атома, который определяется строением и свойствами его электронной оболочки.
В 1913 г. Н. Бор связал в единое целое планетарную модель атома Резерфорда, закономерности проявления линейчатых спектров и квантовый характер излучения и поглощения света. В основе теории Бора лежат выдвинутые им следующие постулаты. Первый постулат (постулат стационарных состояний атома) говорит о том, что у атома существуют стационарные орбиты при движении по которым электрон, несмотря на наличие у него центростремительного ускорения, не излучает электромагнитных волн. Второй постулат Бора (правило квантования орбит) определяет, что электрон, двигаясь по круговой орбите, должен иметь квантованные моменты импульса, удовлетворяющие условию
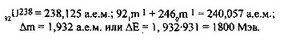 Ln = mevr = nh (п = I, 2, 3,...), h = Ь/2тс,
Ln = mevr = nh (п = I, 2, 3,...), h = Ь/2тс,
где: тс — масса электрона, у — скорость электрона, г — радиус орбиты,
И — постоянная Планка.
Целое число п должно быть равно числу длин волн де Бройля для электрона, укладывающихся на длине круговой орбиты:
2кг/Х = 27tmrv/h = п, отсюда X = 2лтп. (3.6.2) Третий постулат Бора (постулат частот) утверждает, что при переходе атома из одного стационарного состояния в другое испускается или поглощается квант лучистой энергии (фотон).
Ближайшая к ядру орбита соответствует наиболее устойчивому состоянию атома. На данной орбите электрон находится на самом низком энергетическом уровне. При сообщении электрону энергии из вне (при повышении его энергетического уровня), он может перейти на одну из более удаленных стационарных орбит. Чем выше у электрона энергетический уровень, тем дальше от ядра будет находиться его орбита. Атом, имеющий электрон на одном из высоких энергетических уровней, называется “возбужденным”. Средняя “продолжительность жизни” возбужденного атома составляет порядка I О-8 сек. После этого он переходит в нормальное состояние с излучением ранее поглощенной энергии.
На основе данных положений были вычислены радиусы различных, разрешенных квантовыми условиями, стационарных орбит электрона в атоме водорода.
Оказалось, что они относятся друг к другу как 12:22:32:42:::п2. Величинап была названа главным квантовым числом. Радиус ближайшей к ядру орбиты (п = I) для водорода равен 0,53 • IO"8 см, а электрон движется по ней со средней скоростью 2200 км/сек. На второй орбите скорость вращения электрона вдвое, а на третьей втрое меньше, чем на первой и т.д. Радиус первой орбиты и скорость вращения электрона на ней рассчитаны исходя из условия нейтрализации только кулоновских сил притяжения между электроном и ядром центробежной стой, действующей на электрон при его движении по орбите.Планетарная модель атома Бора всего лишь гипотеза, схема, которая более или менее удачно объясняет факты, накопленные физиками и химиками. Она хорошо соответствует наблюдаемому спекТру только одного химического элемента — водорода. Ho данная модель оказалась совершенно непригодной для остальных элементов, начиная с гелия, так как она не учитывает кулоновского взаимодействия электронов между собой. Более того, на ближайшей к ядру орбите длина волны электрона оказывается равной длине ее окружности (к = 2т), и поэтому электрон,
в таком случае, нельзя рассматривать как точечную частицу, движущуюся по орбите вокруг ядра [58].
С созданием квантовой механики на смену модели Бора пришла квантовая модель строения атома (рис. 3.6.1). В основе теории квантовой модели лежат следующие основные положения. Электрон имеет корпускулярно-волновую природу. Он может вести себя и как частица, и как волна. Длина волны электрона и его скорость связаны соотношением де Бройля: X = h/mev. В соответствии с принципом неопределенностей Гейзенберга для электрона невозможно одновременно измерить координату и скорость.
Математическим выражением принципа неопределенности служит соотношение
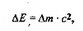
где Ax — неопределенность положения координаты,
Av — погрешность измерения скорости. Электрон в атоме не движется по определенным траекториям (по теории Бора — орбитам), а может находиться в любой части околоядер- ного пространства.
Движение электрона в околоядерном пространстве описывается четырьмя квантовыми числами: главным п, орбитальным L, магнитным гп, и спиновым ms. Квантовые числа используются при построении модели электронных оболочек атомов с учетом принципа Паули, правила Гунда и др. Вид “орбит” (в смысле квантовой механики) определяет орбитальное квантовое число L.Согласно квантовой модели строения атома, состояниям электрона с различными значениями L соответствуют электронные “облака” различ-
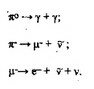
Рис. 3.6.1. Вид «орбит» по квантовой модели
ного вида симметрии. Так, при L = O “орбита” имеет вид окружности, при L= I, 2, 3,... она переходит в эллипс, становясь все более вытянутой с ростом L.
.Число электронов в слоях электронной оболочки атома определяется принципом Паули (1925), который гласит, что в любом атоме не может быть двух электронов, находящихся в двух одинаковых стационарных состояниях, определяемых набором квантовых чисел. , В таблице 3.5.1 приведено максимальное число электронов, находящихся в состояниях, характеризуемых данными значениями главного п и орбитального L квантовых чисел.
Таким образом, отличие квантовой модели атома от модели атома Бора состоит главным образом в форме траекторий (орбит) движения электронов вокруг ядра. И в той и другой модели электроны вокруг ядра движутся под действием кулоновских сил, а их падению на ядро препятствуют центробежные силы.
Таблица 3.5.1
Число электронов в состояниях
|
Слои |
Макс. число электр. |
||||||
|
п |
Обоз. |
S(L = O) |
р (L= I) |
d (L= 2) |
f (L = 3) |
I QQ I ^ ! Il ! |
|
|
I |
К |
2 |
- |
- |
- |
- |
2 |
|
2 |
L |
2 |
6 |
- |
- |
- |
8 |
|
3 |
M |
2 |
6 |
10 |
- |
“ч |
18 |
|
4 |
N |
2 |
6 |
10 |
14 |
- |
32 |
В условиях, когда современная наука не признает существование эфира, который является первоматерией Вселенной и основой для синтеза физической материи, такое объяснение механизма взаимодействия электронов с ядром атома является, вероятно, единственно возможным вариантом.
Вместе с тем известно, что по своему объему ядро и электроны составляют ничтожную долю объема атома. А что же занимает весь остальной объем? По современным представлениям — вакуум, пустота. Ho Природа не любит пустоты. Все пространство Вселенной, физические тела, молекулы и атомы пронизаны, эфиром /А теперь рассмотрим эфирную модель строения атома, в основе которой лежат следующие основные положения. Атом состоит из ядра, электронной оболочки и эфирного поля аТома. Это поле представляет собой структурированную сферу, состоящую из ряда эфирных слоев. Между эфирными слоями располагаются электроны атома. Эфирные слои находятся в постоянном колебательном движении. Колебания эфирных слоев проявляются в виде стоячих эфирных волн, являющимися своеобразными «волнами-пилотами» (по выражению Луи де Бройля). Корпускулярно-волновая природа свойственна только эфирным частицам — эфитонам. И хотя в своей основе элементарные частицы образуются из эфитонов и поэтому каждой из них, в том числе и ядру атома, тоже свойственно постоянное колебательное движении, волны эфирных слоев вызывают «вынужденные» колебания электронов, ядра и всего атома. Частота колебаний эфирных слоев возрастает от ядра атома к его периферии. Определяющую роль в механизме кулоновского взаимодействия между ядром и электронами, а также между электронами электронной оболочки играют эфитоны эфирных слоев. Эфитоны, находясь в узлах решетки эфирных слоев атома, ориентированы своей отрицательной стороной по направлению к положительно заряженному ядру, и этим самым они оказывают противодействие кулоновским силам притяжения электронов к ядру, т.е. играют роль буфера.
Электроны атома под действием стоячих эфирных волн («волн- пилотов») находятся в постоянном колебательном движении относительно ядра в некотором сферическом электронном слое. Энергетика электронов дискретна. Она определяется энергетикой эфитонов электронного слоя и может изменяться (увеличиваться или уменьшаться) только на дискретную величину — квант энергии, величина которого определяется разностью уровней энергетик эфитонов двух соседних электронных слоев атома, и равна постоянной Планка.
А так как частота колебаний эфитонов в ближайшем к ядру электронном слое минимальна, то и электроны в этом слое обладают минимальным уровнем энергетики.Подобных электронных слоев у атома может быть до семи. В ближайшем к ядру слое могут находиться не более 2-х электронов, во втором слое — не более 8-ми, в третьем слое — не более 18-ти, в четвертом слое — не более 32-х, в пятом слое — не более 18-ти (при Z lt; 89) или не более 32-х (при Z gt; 88), в шестом слое — не более 8-ми (при Z lt; 87). Седьмой слой имеется у элементов с Z gt; 86, и в нем находятся не более 2-х электронов. Количество слоев и число электронов в каждом слое было найдено на основ? анализа свойств химических элементов.
Построение простейшей модели атома водорода не представляет трудностей: один электрон и один протон, которые разделены между собой эфирным слоем. Для следующего элемента гелия (Z = 2) возможны уже две различные модели: два его электрона могут находиться как в одном, так и в двух электронных слоях. Ho в последнем случае внеш
ний электрон должен был бы связан в гелии не прочнее, чем электрон в атоме водорода, а по своим химическим свойствам гелий должен по- ходить-на водород. Ho гелий химически инертен. А это свидетельствует
о том, что оба электрона находятся в одном электронном слое и одинаково прочно связаны с ядром.
Следующий элемент литий (Z = 3) имеет три электрона. Для него мысленно можно построить четыре модели. Литий — металл и во всех своих соединениях одновалентный. Поэтому в удовлетворяющей это свойство модели два электрона должны находиться в первом эфирном слое (как у гелия), а третий электрон во втором слое.
Бериллий (Z = 4) всегда является двухвалентен. А это говорит о том, что валентными являются два электрона и оба находятся в одинаковых условиях, т.е. у бериллия, как и у лития, сохраняется устойчивая “гелиевая двойка”, а два валентных электрона располагаются во втором эфирном слое.
Элемент бор (Z = 5) — трехвалентен. Его модель должна содержать два электрона в первом слое и три электрона во втором слое.
Следующий элемент углерод (Z = 6) — четырехвалентен, Отсюда расположение его электронов будет: два в первом слое и четыре во втором.
Таким образом, общая тенденция развития атомных структур состоит в том, что при сохранении «гелиевой двойки» идет последовательное заполнение электройами второго эфирного слоя до значения, при котором химический элемент становится максимально устойчивым, т.е. должен быть инертным газом. Вслед за углеродом идут азот (Z = 7): электрона в первом слое и 5 во втором; кислород (Z = 8): 2 электрона в первом слое и 6 во втором; фтор (Z = 9): 2 электрона в первом слое и 7 во втором. Все они являются химически активными элементами.
Следующий элемент неон (Z = 10): (2 электрона в первом слое и 8 во втором). Это инертный газ, являющийся аналогом гелия. Отсюда можно сделать вывод, что второй электронный слой становится устойчивым при нахождении в нем восьми электронов.
Одиннадцатый элемент — натрий (Z = 11) — одновалентен. Значит, во внешнем эфирном слое должен находиться один электрон. А так как второй слой уже заполнен, то данный электрон должен располагаться в третьем слое. Аналогично для следующего элемента магния. Его два валентных электрона должны находиться также в третьем слое и т.д. Заполнение третьего электронного слоя продолжается вплоть до аргона (Z = 18), когда в этом слое оказывается 8 электронов.
Элемент калий (Z = 19) по своим химическйм и оптическим свойствам аналогичен литию и натрию, и поэтому его 19-й валентный электрон должен находиться один в следующем четвертом слое. Таким образом, начиная с калия, при незаполненном третьем слое начинается заполнение электронами четвертого слоя. Это означает, что вследствие взаимодействия с электронами сила кулоновского взаимодействия 19-го электрона с ядром будет больше при его нахождении в четвертом слое, чем в третьем. Анализ химических свойств кальция (Z = 20) показывает, что его 20-й электрон также должен находиться в четвертом слое.
Начиная со скандия (Z = 21) возобновляется нормальное заполнение электронами третьего слоя, которое заканчивается у меди (Z -29). Далее, до криптона (Z = 36), который завершает четвертый период периодической системы элементов, идет нормальное заполнение электронами четвертого слоя. Следующий элемент рубидий (Z = 37) аналогичен атомам щелочных металлов натрию и калию. Поэтому его 37-ой электрон должен размещаться в пятом слое, хотя четвертый слой еще не достроен. У атома стронция (Z = 38), который по своим свойствам аналогичен кальцию, электрон также занимает свое место в пятом слое. Начиная с иттрия (Z = 39) и до палладия (Z = 46) заполняется электронами четвертый слой, при этом изменяется число электронов в пятом слое от двух у иттрия до нуля у палладия. Далее с серебра (Z = 47) вновь заполняется пятый слой, а с цезия (Z = 55) — шестой слой и т.д.
На движение электрона оказывают влияние не только кулоновские силы притяжения его к ядру, но также и кулоновские силы отталкивания от соседних электронов, находящимися в этом слое, а также силы взаимодействия между этим электроном и ядрами соседних атомов. На каждый электрон будет действовать суммарная векторная кулоновская сила, определяемая состоянием эфирного поля (его электрической составляющей) в точке нахождения электрона. В этих условиях для обеспечения движения в слое электрону требуется некоторое минимально “разрешенное” пространство (зона). За единицу такого пространства примем площадь сферы слоя, приходящуюся на один электрон. В первом слое могут находиться два электрона. Отсюда площадь, приходящая на один электрон, будет равна S = 4п r,2/2 = 2пг,2. Во втором слое могут находиться 8 электронов, а площадь сферы этого слоя в расчете на один электрон будет равна 4пг22/8. Аналогично для третьего слоя площадь сферы на один электрон будет равна 4пг32/18, а для четвертого слоя — 4пг 2/32.
4
Представляется, что сферические площади, приходящиеся на один электрон, во всех слоях одинаковы. Тогда отношение среднего радиуса второго слоя к первому найдем из соотношения:
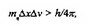
Подобным образом находим, что T3= Зг,, гч= 4г,, т.е. средние радиусы электронных слоев относятся как 1:2:3:4. Начиная с пятого слоя,
действие кулоновских сил притяжения электронов к ядру относительно других сил значительно уменьшается и начинает возрастать «разрешенное» для электронов пространство. Однако, по аналогии с первыми четырьмя слоями, можно предположить, что отношение радиусов электронных слоев будет также описываться рядом натуральных чисел 1:2:3::: п.
Каждый электронный слой имеет некоторую «толщину», которая определяется разностью между максимальным 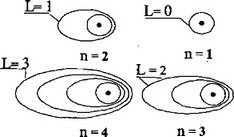 и минимальным радиусами слоя. В зависимости от своего энергетического состояния электрон в слое может занимать различное положение: электрон с минимально допустимым для этого слоя уровнем энергетики располагается на расстоянии минимального радиуса слоя, а с максимальным уровнем энергетики на расстоянии максимального радиуса. Текущее энергетическое состояние электрона определяется энергетическим уровнем окружающих его эфитонов, Таким образом, в каждом слое энергетический уровень электрона может изменяться непрерывно от некоторого минимального уровня до максимального уровня, допустимых для данного электронного слоя.
и минимальным радиусами слоя. В зависимости от своего энергетического состояния электрон в слое может занимать различное положение: электрон с минимально допустимым для этого слоя уровнем энергетики располагается на расстоянии минимального радиуса слоя, а с максимальным уровнем энергетики на расстоянии максимального радиуса. Текущее энергетическое состояние электрона определяется энергетическим уровнем окружающих его эфитонов, Таким образом, в каждом слое энергетический уровень электрона может изменяться непрерывно от некоторого минимального уровня до максимального уровня, допустимых для данного электронного слоя.
На рисунке 3.6.2 приведена модель атома магния. В ней электроны в слоях условно показаны в плоскости «экватора» атома (по долготе), хотя реально (по широте) они могут занимать любое место в своей зоне.
Наличие у твердых тел электронных слоев определенной толщины подтверждается результатами опытов: спектры поглощения твердых тел в оптической области и области мягких рентгеновских лучей состоят из отдельных широких полос. Взаимосвязь структуры энергетических уровней и соответствующих им спектров излучений для большинства атомов очень сложна.
Ho одной из наиболее известных спектральных линий является, например, D-линия натрия. Если посыпать немного соли на пламя газовой горелки, то будет наблюдаться яркий желтый свет. Анализ испускаемого света с помощью спектрометра показывает, что имеются две близкие
линии: одна с X - 5,896 • IO-7 м, а другая с X = 5,890 • IO-7 м. Многие спектральные линии оказываются дублетами, триплетами и даже муль- типлетами.
Длина волны колебаний электрона располагается в диапазоне от световых волн до рентгеновских излучений и составляет примерно X = = 2 • 10~9 - 7 • IO-7 м. Электроны всех слоев электронной оболочки атома являются источниками образования световых волн. При повыг шении температуры амплитуда колебаний электронов начинает возрастать, и когда она достигает определенной величины, то такой электрон начинает вызывать возмущения в окружающей атом эфирной среде, которые распространяются в виде эфирных (электромагнитных) волн различной длины. Длина эфирной волны определяется частотой колебаний электронов, вызвавших эту волну. (
Наличие у натрия в D-линии дуплета определяется тем, что первая из них (X = 5,896 ¦ IO-7 м) вызывается колебаниями электронов, находящимися н? минимальном радиусе электронного слоя, а вторая линия (X = 5,890 • 10~7 м) — электронами, находящимися на максимальном радиусе этого же слоя. Появление в спектральных линиях триплетов говорит о том, что в электронном слое электроны могут занимать и средние положения.
Строение атома и явление поглощения (абсорбции) света веществом взаимосвязаны между собой. Известно, что если на поверхность вещества падает параллельный пучок света (плоская волна) с интенсивностью J0, то по мере проникновения волны в вещество эта интенсивность падает по закону Бугера:
alt="" />(3.6.3)
где: а — коэффициент поглощения вещества (зависит от длины волны);
d—толщина слоя.
Зависимость коэффициента поглощения от длины волны для конкретного вещества обычно дается в виде таблицы или графика. Как правило, спектры поглощения твердых тел и жидкостей дают широкие полосы поглощения, т.е. наблюдается плавный ход изменение коэффициента а от длины волны. Ho для отдельных веществ эта зависимость принимает причудливый вид, обнаруживая существование довольно узких областей сильного поглощения (большое значение а), в то время как близкр расположенные длины волн проходят.без заметного ослабления. Так для паров натрия коэффициент поглощения может быть изображен в виде кривой, приведенной на рисунке 3.6.3.
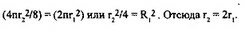
Если области резкой абсорбции соответствуют частотам собственных колебаний электронов в электронных слоях атома, то три дуплета сильного поглощения, наблюдаемые в парах натрия, должны вызываться абсорбцией энергии света, падающего на электроны атома, которые находятся в трех электронных слоях, т.е. каждому электронному слою атома соответствует свой дуплет.
У газов, молекулы которых содержат несколько атомов, обнаруживаются такие же собственные частоты, которые соответствуют частоте колебаний атомов внутри молекулы. А так как масса атома в десятки тысяч раз больше массы электрона, то собственные частоты атомов значительно ниже собственных частот электронов и лежат в инфракрасной области.
Такова эфирная модель строения атома, в которой одной из основных составляющих (наряду с ядром и электронами) является его эфирное поле, а электроны совершают волновое движение в электронных слоях в некотором «разрешенном « для них пространстве (вместо вращения вокруг ядра).
Еще по теме Эфирная модель строения атома:
- 3.3. Модель строения атомного ядра
- Гипотетическая модель строения и свойств эфира
- Математические модели в экологии. Модели биогеоценозов
- Эфирная и физическая материи
- 5.11. Эфирные взрывы. Тунгусский метеорит
- Взаимодействие эфирных полей тел. Эффект Казимира
- Токсические растения, содержащие эфирные масла
- РОЛЬ ЭФИРНЫХ МАСЕЛ В УСТОЙЧИВОСТИ ЛУКА К ПОРАЖЕНИЮ МИКРООРГАНИЗМАМИ
- Метод экстракции липидов спиртово-эфирной смесью (по Блюру).
- Анализ моделей и сценариев
- Модели роста популяций.
- Простые модели размножения
- Микерников Николай Григорьевич. Эфир Вселенной и современное естествознание. Основы эфирной физики, 2009
- Модели межклеточного взаимодействия и формообразования
- 3. Познавательные модели эволюционизма
- Модели изложенных теорий
- 1-11. Человек - модель эволюции