Классификация морских донных растительных сообществ
Прежде всего, отметим необходимость различать понятия «флора» и «растительность», которые часто ошибочно употребляют как синонимы, в результате чего появляются недопустимые словосочетания типа «продукция донной флоры».
Флора какого-либо региона или биотопа — это список видов, обитающих в изучаемом месте. Наука, изучающая видовой состав, называется флористика. Растительность, в нашем случае донная морская, — предмет морской фитоценологии, или гидроботаники, изучающей группировки растений фитобентоса (К. Петров, 2004). Все количественные экологические характеристики можно относить только к термину «растительность». Фитоценология исследует, прежде всего, закономерности распределения растительного покрова. Для флористики все виды равны, для фитоценологии важно определить ранг каждого вида, его роль в сообществе. Если мы говорим, что «во флоре доминируют такие-то таксоны», это значит, что в списке видов представителей именно таких таксонов больше всего. Если же мы говорим «доминантами растительности являются такие-то таксоны», то это значит, что растения именно этих таксонов играют самую значительную роль в метаболизме сообщества, преобладая по биомассе, численности и продукции.Для описания морской донной растительности гидроботаники широко используют геоботаническую терминологию и системы классификации, а геоботаники, в свою очередь, пытаются, по мере возможности, учесть водную растительность в своих схемах.
Понятия «ассоциация» и «фитоценоз» различны. Каждый локальный фитоценоз есть представитель своей ассоциации (Шенников, 1964), которая обычно распространена в конкретном бассейне существенно шире фитоценоза и перемежается фитоценозами других ассоциаций. Например, в Чёрном море на мысах с активной гидродинамикой и скальными выходами развиваются фитоценозы с доминированием Cystoseira spp., а в закрытых бухтах между этими мысами — фитоценозы с доминированием Enteromorpha spp.
Соответственно, фитоценозы мысов входят в одну ассоциацию, фитоценозы бухт — в другую.В характеристику ассоциаций, кроме числа видов, входят также: число ярусов растительности; проективное покрытие дна всей ассоциацией или её основными компонентами (определяют на глаз, выражают в %%); относительное обилие видов (также определяют на глаз и выражают в условных единицах по шкале Друде[§§§§§] или в баллах); количественные показатели — численность, экз./м2 (которую реально подсчитать только для крупных растений) и биомасса, г или кг/м2. В последнее время разработаны новые методы изучения структурно-функциональных особенностей донных растительных сообществ, появились новые термины и измеряемые величины: например, суммарная площадь поверхности сообщества (Миничева, 1990, 1996) или ближайшее функциональное пространство (БФП, Хайлов и др., 1995).
Начало интенсивного изучения донной растительности связано с изобретением Жаком Ивом Кусто и Эмилем Ганьяном акваланга в 1946 г. До этого бентосные растения, особенно растущие на больших глубинах, изучали только дистанционными методами, добывая их со дна драгами и тралами. Естественно, что таким способом можно было получить информацию только о флористическом составе, но никак не о структуре сообществ. Поэтому, в отличие от геоботаники, имеющей долгую историю, восходящую к Карлу Линнею и Александру Гумбольту, гидроботаника активно развивается немногим более полувека, а всю донную растительность долгое время рассматривали как единое целое, и в гео- ботанической литературе объединяли под названием Thalassium, т. е. тип морской растительности, входящий в формацию водных растений Hydatophyta (Diels, 1908) или как три класса водных растений: сообществ плавающих растений (Lemnetea), сообществ «подводных лугов» (Zosteretea marinae) и сообществ солоноватоводных водоёмов (Ruppietae mar- itimae) (Braun-Blanquet (1964), обе цитаты — по: Калугина-Гутник, 1975).
Первым отечественным морским фитоценологом была Н.В. Морозова-Водяницкая (1959), применившая к морской растительности понятие «ассоциация», заимствованное из геоботаники, при описании фитобентоса Черного моря, в биогеографическом отношении являющимся единым регионом (за исключением распреснённых районов).
Она выделила 10 ассоциаций донной растительности — от супралиторали до нижней сублиторали (90-100 м). Ею же впервые была выделена отдельная ассоциация, приуроченная к загрязнённым участкам моря. Само понятие «ассоциация» автор определяет, как группу организмов со следующими свойствами: 1) определённый видовой состав; 2) наличие набора «константных» видов, которые присутствуют в ассоциации постоянно; 3) определённая физиономичность группировки, зависящая от количественного соотношения видов; 4) определённые требования к экологическим условиям, т. е. определённые отношения между компонентами ассоциации и средой; 5) наличие определённых взаимоотношений между видами внутри ассоциации. Следует отметить, что Н.В. Морозова-Водяницкая опередила таких корифеев экологии, как E.R Odum (1971) и С. den Hartog (1981), введя в определение ассоциации элементы структурно-функционального подхода, а не только флористики.К.М. Петров (1961) впервые предложил развёрнутую систему классификации для Чёрного и Каспийского морей на основе жизненных форм донных растений. Он выделил 66 растительных ассоциаций, объединив их в 24 формации и 6 типов растительности: 1) бентосные сообщества диатомовых водорослей; 2) сообщества однолетних зелёных, бурых и красных водорослей; 3) сообщества известковых кустистых красных водорослей; 4) сообщества многолетних красных и бурых водорослей; 5) сообщества корковых водорослей и 6) сообщества морских трав.
Более стройную, иерархически организованную схему предложила А.А Калугина- Гутник (1975) для Чёрного моря. Донная растительность разделена на два типа: тип растительности морских водорослей (Thalassophycion) и тип растительности морских трав (Thalassopoion). Внутри первого типа выделены классы формаций сообщества твёрдых грунтов (Thalassophycion sclerochthonophytia) и рыхлых грунтов (Th. malacochthonophy- tia). В первом классе выделены три группы формаций: сообщества зелёных, бурых и красных водорослей, а ко второму классу относятся только группы формаций сообщества ха- ровых водорослей.
Формации выделяют по доминирующему виду или виду-эдификатору: если это UI- va, то формация называется Ulveta, если Cystoseira — Cystoseireta, если Phyllophora — Phyllophoreta. Формации делят на ассоциации, которые выделяют по доминантам каждого яруса. Их названия записывают, например, так: асе. Cystoseira crinita + С. barbata — Cladostephus spongiosus — Corallina mediterranea. Это значит, что первый, самый высокий ярус растительности создают два вида цистозиры — эдификаторы фитоценоза, во втором ярусе доминирует кладостефус, а в третьем, нижнем — кораллина. Приведённая нами для примера ассоциация — самая широко распространённая в Чёрном море, она входит в число так называемых региональных ассоциаций, т. е. распространённых по всему региону. В общей сложности А.А. Калугина-Гутник выделила 40 ассоциаций, различающихся не только по видовому составу, но и по продолжительности вегетации: 8 из них однолетние, 26 — многолетние, 6 — эфемероидные, т. е. наблюдающиеся только зимой (сезонно зимние — 4) или только летом (сезонно летние — 2). Отметим, что через 16 лет после публикации работы Н.В. Морозовой-Водяницкой (1959) ассоциаций, приуроченных к загрязнённым местообитаниям, стало уже 9.
В супралиторальной зоне (высота над нулём глубин 0,1-1,5 м) наблюдается всего три ассоциации; в псевдолиторальной (по 0,1 м от нуля вверх и вниз) — четыре. В приливных морях, с выраженной литоральной зоной, ассоциаций может быть больше. В Чёрном море самый богатый I этаж (0,1-5 м): сюда проникает до 30% поверхностной солнечной радиации, здесь найдено 22 ассоциации. Во II этаже (5-15 м) — 6 ассоциаций, в III этаже (15-25 м, до 2% солнечной радиации) — всего 5. Ещё глубже располагаются два этажа, занятые шестью ассоциациями сциафильных водорослей, которым для вегетации достаточно проникающих сюда 0,5-1,5% света. 30 лет назад, когда была издана монография А.А. Калугиной-Гутник (1975), нижняя граница черноморской фитали проходила на глубине 80-90 м, и самый нижний этаж занимала однолетняя ассоциация немногочисленных нитчатых водорослей.
В настоящее время не осталось и следов этой ассоциации, а фиталь в большинстве мест заканчивается на глубине не более 20 м. Многие ассоциации, наблюдавшиеся ранее, исчезли, зато появились новые, в том числе связанные с местообитаниями, подвергающимися постоянному антропогенному загрязнению (Максимова, Лучина, 2002; Максимова, Моручкова, 2005). Изменения, происходящие в макрофитобентосе, неразрывно связаны с глобальной перестройкой всей черноморской экосистемы, наблюдаемой в последние 20 лет и вызванной антропогенной эвтрофикацией бассейна, а также вселением в Чёрное море безвыборочного планктонного хищника — гребневика Mnemiopsis leidyi (Кучерук и др., 2002).В других морях расположение горизонтов и этажей принципиально не меняется, но их глубины могут быть иными. Например, в тропических морях с высокой прозрачностью фотофильный горизонт продолжается до глубины 100 и более метров (Калугина-Гутник, 1975; Возжинская, 1977).
Упомянем систему водной растительности, предложенную голландским гидроботаником С. den Hartog (2003). Критикуя узкий флористико-статистический подход к классификации растительности («... statistics may help to find interesting correlations, it does not explain anything», 1971: 173), он, вслед за Ю. Одумом, говорит о необходимости учёта структурно-функциональных характеристик конкретного фитоценоза, включая сюда и продуционно-деструкционные процессы. Базируясь на иерархической системе J. Braun- Blanquet, он выделяет 7 классов сообществ морских трав: Zosteretea, Halodulo-Thalassie- tea, Phyllospadicietea, Posidonieta, Thalassodendro-Amphiboletea, Thalassodendretea ciliatae и Ruppietea. Классы он подразделяет на порядки (orders), а порядки — на альянсы (alliances). Например, класс Zosteretea включает сообщества песчаных и илистых грунтов в морских и опреснённых водоёмах умеренных зон Северного и Южного полушарий. Класс подразделён на 2 порядка: Zosteretalia, который представлен сообществами Zostera subgen. Zostera северного полушария; и Nanozosteretalia, в который включены сообщества Zostera subgen.
Zosterella (= Nanozostera), встречающиеся как в Северном, так и в Южном полушарии. Каждый порядок этого класса содержит по одному альянсу. В классе Posidonietea выделяет один порядок Posidonietalia с тремя альянсами. Первый, Posidonion oceanicae, включает сообщества Posidonia oceanica из Средиземного моря. Второй, Posi- donion australis, объединяет сообщества P. australis, P. angustifolia и P. sinuosa умеренных вод Австралии, характеризующиеся относительно небольшой глубиной распространения (до 15 м). Третий, Posidonion coriacea, образован сообществами пяти видов Posidonia (Р. coriacea, P. robertsoniae и др.), обитающих на юго-западе и юге Австралии, в местах с высокой гидродинамической активностью.Итак, существует много классификаций водной растительности, построенных на разных принципах и подходах. Использование той или иной классфицкации (или создание собственной) обусловлено основными задачами конкретного исследования, теми вопросами, на которые хочет ответить автор, и один и тот же автор в разных случаях часто пользуется разными системами. С изменением способа и критериев отбора меняется и классификация. В настоящее время в гидроботанике ассоциации выделяют как некий статистический артефакт, получающийся в результате группировки станций (проб) тем или иным способом. Главный недостаток перечисленных классификаций — полное игнорирование ими несомненно происходящих сукцессионных изменений. Приходится отметить, что изучение сукцессионных процессов в морских донных растительных сообществах находится на самой начальной стадии. Поэтому ниже описаны наиболее типичные и широко распространённые типы донных растительных сообществ, выделенные в первую очередь по физиономическому облику.
«Искусственная физиономическая классификация ассоциаций в пределах ботанико-географического района, безусловно, полезна. Она помогает ориентироваться в многообразии сообществ... Распространять подобную физиономическую классификацию за рамки района совершенно недопустимо. Район представляет собой единое эколого-ценотическое целое и только сам, как целое, может быть единицей классификации. Расчленить сукцессионные системы разных районов на части и, смешав эти части, подвергать их затем классифицированию — процедура столь же малополезная, как составление классификаций отдельно плодов, отдельно тычинок и т. д.» (Разумовский, 1981: 187-189).
Сообщества морских трав
Морские травы образуют обширные «подводные луга» на мелководьях почти повсеместно, лишь в Арктике и Антарктике, а также в тропиках восточной Пацифики и восточной Атлантики, на юге Южной Америки и в Новой Зеландии морские травы отсутствуют. Ряд видов имеет весьма широкие ареалы. Например, Zostera marina обитает у европейских берегов от Средиземного моря бассейна до Арктики, у южной оконечности Гренландии, по обоим побережьям Северной Пацифики, включая Калифорнию, и на Атлантическом побережье Канады и США. Солелюбка Halophila ovalis распространена от восточного побережья Африки, включая Красное море, через весь Индийский океан до юга Японии и островов Самоа и Тонга в Тихом океане. Другие виды имеют строго ограниченный ареал; так, Zostera mucronata обитает только на самом юге Австралии и в Тасмании, a Posidonia oceanica, несмотря на своё название, растёт только в Средиземном море (Phillips, Menez, 1988).
Морские травы, благодаря наличию у них корневищ, могут закрепляться в рыхлом грунте (иле, песке) и обычно образуют на них обширные подводные луга. Почти все морские травы лучше всего растут на илистом песке, лишь некоторые виды предпочитают скалы (северо-тихоокеанский бореальный род Phyllospadix, один вид которого — P. iwa- tensis обитает в российских водах в Японском море, южноавстралийский род Amphibolis, и индо-малайский Thalassodendron ciliatum), но только представители Phyllospadix способны противостоять сильным течениям и прибою. Морские луга практически никогда не осушаются, разве что во время самых сильных (сизигийных) отливов.
Halophyla ovalis
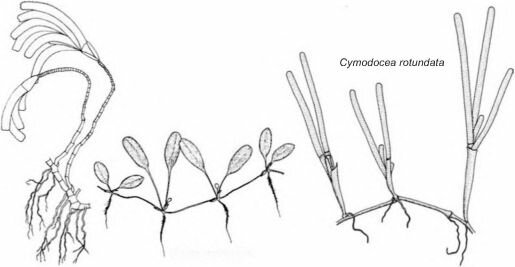
Thalassodendron ciliatum
Рис. 3.29. Морские травы. По Menez, Phillips, Calumpong (1983).
Морские травы приспособились к обитанию в морской воде настолько, что даже плодоношение у них происходит под водой, а способ опыления их цветков называется «гидрофилия», т. е. пыльца разносится водой. Рыбы, питающиеся семенами Ruppia maritima, способствуют расселению вида: семена проходят через их кишечник, не теряя всхожести.
Хотя морские травы способны расти как в пресной воде, так и при солёности до 42%о (кратковременно — до 100%о), оптимальна для них солёность 10-30 %о, при более низкой солёности, в наиболее распреснённых участках эстуариев и лагун, их вытесняют сообщества, где доминируют наиболее эвригалинные пресноводные по происхождению виды, в наших водах — это представители рода рдест (Potamogeton).
Морские травы довольно эвритермны: характерная для умеренных вод Zostera способна цвести и продуцировать семена при температурах от 0 до 30°С (в северной части ареала — до 13°С), тропические травы нормально вегетируют при температурах 17-32°С.
Морские травы возникли уже в мелу, т. е. почти одновременно с наземной растительностью и гораздо раньше сообществ пресноводных высших растений. Однако появление покрытосеменных в море не привело к возникновению или расцвету связанных с ними крупных таксонов животных, как это произошло на суше, на водных покрытосеменных живут преимущественно те же виды, что и на водорослях-макрофитах (лишь в тропиках есть виды, специализирующиеся на питании морскими травами), а в грунте — те же, что в рыхлых грунтах, окружающих луга. Тем не менее подводные луга — весьма специфические сообщества (рис. 3.30).
Продукционная способность морских трав исключительно высока, их сообщества — среди наиболее продуктивных автотрофных сообществ планеты, включая сельскохозяйственные. Так, взморник за год образует 0,3-0,6 кг/м2 сухой массы (без учёта продукции корней). Годовая продукция талассии в Карибском бассейне колеблется от 88 г до 4 кг С/м2. Аналогичный показатель для зостеры (США) — от 6 до 1,2-1,5 кг С/м2. Для сравнения: сельскохозяйственные зерновые продуцируют за год 0,4-0,5 кг С/м2, сахарная свёкла — более 0,75 кг С/м2, а сахарный тростник — до 1,7 кг С/м2. В пределах района обитания продуктивность «подводных лугов» выше, чем у местного фитопланктона. Скорость роста листьев некоторых видов составляет 5-10 мм в сутки (Mann, 1973; Phillips, 1978). При этом у многолетних видов до 50-95% биомассы может быть под поверхностью грун-
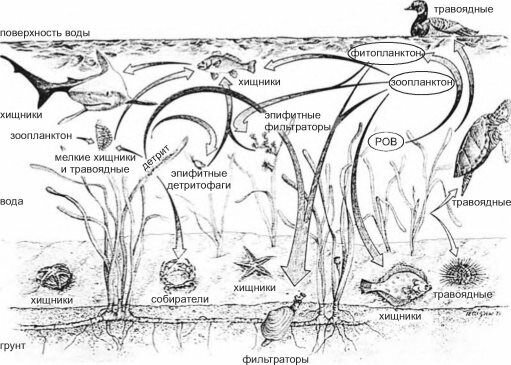
инфауны
Рис. 3.30. Схема пищевых сетей лугов морских трав. По Phillips (1978).
та. В отличие от макроводорослей, морские травы усваивают биогены корнями, через корневые волоски — т. е. так же, как и наземная растительность. Азот в экосистему морских лугов поставляют азотфиксирующие синезелёные, имеются данные и о наличии симбиотических азотфиксирующих бактерий у самих морских трав. Листья морских трав покрыты эпифитными микроводорослями, микроводоросли образуют водорослевые маты на поверхности грунта. На взморнике обитает до 200 видов эпифитных водорослей (den Hartog, 1970). В результате вклад в суммарную первичную продукцию морских лугов самих морских трав можно оценить в 50% (den Hartog, 1979). Вся эта продукция может потребляться непосредственно. Например, лебеди и ряд других водоплавающих птиц питаются листьями взморника. В тропиках на лугах Thalassia в буквальном смысле слова пасутся несколько видов морских черепах (потому её и называют черепашьей травой), а также дюгони и ламантины.
Существенная часть продукции подводных лугов идёт на образование детрита, как в пределах самих лугов (особенно это относится к подземным частям растений), так и вне их. Листья трав, как и талломы макроводорослей, при отмирании в значительной мере скапливаются на берегу, образуя штормовые выбросы, или напротив — их сносит на глубину. Скопления Thalassia testudinum были обнаружены на дне на глубинах более 3100 м в районе Северной Каролины, т. е. в 540-1080 км от места её произрастания (Флорида, Багамские и Бермудские о-ва) (Menzies et al., 1967). Авторы считают, что затонувшие морские травы служат важным источником органического вещества в абиссали. Впрочем, по наблюдениям Н.В. Кучерука (личн. сообщ.), в глубоководных желобах Атлантики, куда поступает огромное количество остатков морских трав, фауна существенно беднее, чем, например, в желобах Тихого океана. Видимо, избыток органического вещества, медленно разлагающегося при постоянно низких температурах, не столько идёт на пользу ультра- абиссальной фауне, сколько угнетает её. В любом случае, очевидно, что влияние морских трав не ограничивается зоной их произрастания.
Морские луга часто образуют плотную дерновину. Так, по данным В.Н. Вехова (1992), суммарная протяжённость корневищ беломорской Zostera marina колеблется от 20 до 300 м на 1 м2 занятой зарослями площади, при этом от каждого метра корневища отходит до 300—400 корней. Дерновина не только стабилизирует грунт, препятствуя его размыванию течениями и штормами, но и служит укрытием для инфауны. Биомасса инфауны в зарослях существенно выше, поскольку в грунте внутри зарослей организмы менее доступны для хищников. В Чёрном море фильтратор инфауны двустворчатый моллюск Cha- melea gallina ещё лет тридцать назад доминировал на песках глубже прибрежного фронта. В последние годы колоссальную вспышку численности дала Rapana venosa, и она полностью уничтожила Ch. gallina на открытых песках. На лугах зостеры Rapana не может преодолеть «забор» из стеблей и корневищ взморника, и поэтому численность Chamelea внутри и вне зарослей различается на один-два порядка на расстоянии всего нескольких сантиметров (Н.В. Кучерук, лич. сообщ.). Недавно в Белом море была обнаружена ранее не описанная экада самого массового литорального вида Fucus vesiculosus (Максимова, Мюге, 2007). Характерной особенностью этой экады, названной ecad vehovianus, является отсутствие органов прикрепления. Такие растения не могли бы существовать без «помощи» зостеры: их просто вынесло бы на берег. Однако узкий таллом экады так плотно переплетается с корневищами и корнями взморника, что надёжно удерживается на месте даже во время штормов.
Подводные луга существенно снижают гидродинамику, способствуя усиленному осадконакоплению в зарослях. Например, луга широко распространённого в верхней вы- сокобореальной сублиторали Северного полушария сообщества Zostera marina столь эффективно задерживают детрит, что детритофаги дают до 90% биомассы зообентоса, превосходя по биомассе саму Z. marina. В лагунах северо-восточного Сахалина средняя биомасса Z. marina составляет 0,53±0,25 кг/м2 при проективном покрытии 60%, а доминирующего детритофага —Масота balthica — 0,76±0,06 кг/м2 при средней плотности 960±70 экз./м2 (Кафанов и др., 2003).
Среди морских трав обитает масса коммерчески важных животных, таких как креветки, крабы, двустворчатые моллюски. Ещё в 1891 г. C.G.J. Petersen утверждал, что рыбное богатство прибрежных вод Дании обусловлено обширными зарослями взморника. Заросли беломорской Zostera marina — основное место нереста сельди, и после массовой гибели зостеры уловы беломорской сельди резко упали (Вехов, 1992; Phillips, Menez, 1988; Dawes et al., 2004).
Практически нет данных по сукцессионным процессам морских лугов. Лишь наиболее катастрофичные события привлекают общее внимание. К таким событиям следует отнести катастрофическое вымирание Zostera marina в результате заболевания, вызываемого миксомицетом Labirynthula («wasting disease»). Начавшись в 1931 г. на атлантическом побережье Северной Америки, болезнь скоро была отмечена в европейских водах. Последствия болезни были катастрофичными: до 90% морских лугов в бореальных водах Северной Атлантики исчезли, местами гибель достигала 100%.
Покрытосеменные, связанные с морем, обитают и в верхних горизонтах литорали: это растительность солёных маршей умеренных широт и мангров тропиков. Они приурочены к местам повышенного осадконакопления и распреснения. Продуктивность маршевых сообществ вполне сопоставима с продуктивностью «подводных лугов» и сельскохозяйственных культур. Годовая продукция Spartina alterniflora в разных местообитаниях колеблется от 200 до 900 г С/м2, ассоциированные с ней фукоиды продуцируют, по разным оценкам, от 150 до 300 С/м2 (Mann, 1973; Brinkhuis, 1977).
Фукоиды (порядок Fucales) — самые эволюционно продвинутые среди бурых водорослей. Они имеют не только развитые ткани, подобно сосудистым растениям, но и половой процесс, напоминающий таковой у цветковых. Крупные разветвлённые многолетние талломы представляют собой диплоидный спорофит, а гаметофит редуцирован до выстилки концептакулов (скафидий), в полостях которых вызревают гаметангии — мужские и женские. Разные виды фукоидов, даже в пределах одного рода, могут быть как однодомными (Fucus spiralis, F. virsoides, F. distichus, F. evanescens), так и двудомными (F. vesicu- losus, F. ceranoides, F. serratus). Фукоиды более обильны в Северном Полушарии, но ряд видов обитает и в Южном (например, Hormosira banksii). В морях России известно несколько северных видов из сем. Fucaceae: F. vesiculosus, F. distichus, F. serratus, Ascophyl- lum nodosum, Pelvetia canaliculata, а также неприкреплённые формы, одну из которых на Западе считают отдельным видом — Fucus cottoniv, в Чёрном море обитают два вида сем. Cystoseiraceae (Cystoseira barbata, С. crinita); на Дальнем Востоке — Fucus evanescens, Pelvetia wrightii, Cystoseira crassipes и пять представителей сем. Sargassaceae — Sargassum pallidum, S. miyabei, S. horneri, S. thunbergii и Coccophora langsdorfu (Ю. Петров, 1977, Клочкова, 1996) (рис. 3.31).
Рис. 3.31. Фукоиды.
Fucus vesiculosus по Кузнецову (1960); Pelvetia canaliculata по Зиновой (1953); Ascophyllum nodosum no Rueness (1998); Turbinaria turbinata no Taylor (1960).
Fucus vesiculosu
Turbinaria
turbinata
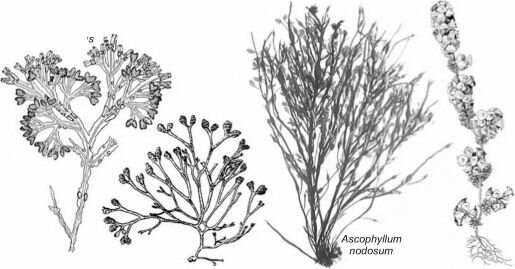
Pelvetia
canaliculata
Фукоиды — доминанты и эдификаторы сообществ литорали и верхнего горизонта сублиторали морей умеренного пояса, саргассовые (Sargassum, Turbinaria) доминируют среди макроводорослей тропических морей, уступая по биомассе и продукции лишь морским травам. Их заросли достигают 100% проективного покрытия, а биомасса разных видов колеблется от 0,1-0,5 кг/м2 (беломорская Pelvetia canaliculata) до 40 кг/м2 (дальневосточная P. wrightii) (Возжинская, 1961, 1986). Биомасса аскофиллума может достигать 60 кг/м2, хотя обычно не превышает 8-10 кг/м2 (Кузнецов, 1960). Размеры взрослых талломов составляют от 30-50 см до метра, они формируют первый (верхний) ярус растительности, а ниже может сформироваться ещё два-три яруса более низкорослых форм, вплоть до корковых багрянок. Годовая продукция ассоциаций фукоидов в Белом море колеблется от 2 до 18 кг/м2 в сырой массе (Возжинская, 1986). Черноморские цистозиры продуцируют
за год до 8,6 кг/м2, P/В коэффициэнт равен 2,2. Их максимальная биомасса — 21 кг/м2, средняя — около 3,5 кг/м2(Калугина-Гутник, 1975).
На всех фукоидах развивается богатый перифитон. В Белом море наиболее обычной эпифитной водорослью является бурая Elachista fucicola, обрастающая стволик таллома, а по окончании плодоношения быстро поселяющаяся на разрушающихся рецептакулах. Кроме неё обычны Cladophora sp. и Polysiphonia fucoides. Талломы фукоидов использует как субстрат молодь мидий Mytilus edulis, под плотными щётками которой иногда не видно самого таллома. Мидии играют существенную роль в выживании фукоидов в прибойных местах: они так прочно скрепляют ветви таллома биссусом, что на литорали образуется настоящий конгломерат, который бывает практически невозможно разделить на отдельные растения. Если же всё-таки удалить всех мидий, то оказывается, что часть талломов даже не была прикреплена к субстрату. Тем не менее, на таких талломах развиваются нормальные и обильные генеративные органы, т. к. макрофит «чувствует себя» прикреплённым. Естественно, что такой конгломерат, занимающий иногда площадь в несколько квадратных метров, успешнее противостоит волнению, чем отдельные растения.
Помимо мидий, среди животного населения, ассоциированного с фукоидами, много брюхоногих моллюсков (Littorina, до нескольких десятков особей на один таллом), боко- плавов, гидроидов, а в эстуариях — изопод (Iera). Мейобентос представлен нематодами и клещами-галакаридами. Полихеты Spirorbis granularis, Circeus armoricana, Bushiella gran- ulata, B. quadrangularis служат маркёром возраста фукоидов: оседание их личинок происходит раз в год, и на талломах фукусов бывает заметно несколько отстоящих друг от друга зон сосредоточения их белых спиральных трубочек. Это не очень надёжный признак, но как вспомогательный может использоваться (Кузнецов, 1960).
На черноморских цистозирах развивается более богатая синузия эпифитов, главными составляющими которой являются две багрянки: Polysiphonia subulifera и Laurencia obtusa. Полисифония стала почти облигатным эпифитом, не встречаясь в эпилитном состоянии, а лишь в виде неприкреплённых спутанных масс в прибрежье. Всего эпифитная синузия цистозировой ассоциации насчитывает около 40 видов, будучи самой богатой на глубинах 2-5 м. В последние годы в Чёрном море наблюдаются вспышки численности то одного, то другого эпифитного вида (2002 г. — Chondrophycus paniculatus, 2003 г. — Stilo- phora rhizodes, Chondria capillaries) — настоящее «цветение» эпифитов, что является признаком эвтрофированности бассейна. Доля синузии в биомассе сообщества может достигать 35-40%, а иногда (как это было в конце 1980-х гг.) даже преобладать по массе над ба- зифитом.
Как и у беломорских фукоидов, самым массовым представителем зооперифитона цистозиры являются митилиды — Mytilus galloprovincialis и Mytilaster lineatus. Их спат многослойным панцирем одевает подошву и толстый бугристый стволик Cystoseira barba- ta, что позволяет быстро отличить этот вид от С. crinita: на тонкие и гладкие стволики последней митилиды практически не садятся.
Перифитон играет значительную роль в продуктивности базифитов: большое количество обрастателей затеняет поверхность таллома хозяина и препятствует его фотосинтезу. Однако, диатомовый оброет макрофитов находится в функциональном динамическом равновесии с базифитом: первичная продукция таллома с диатомовым обрастанием равна продукции чистого таллома (на единицу массы), хотя продукция счищенных диато- мей существенно выше, чем продукция базифита. Значит, «находясь вместе, макрофит и диатомеи снижают фотосинтетическую активность, однако в сумме дают величину фотосинтеза, близкую к таковой необросшего макрофита» (Бондарчук, 1980: 114). На примере черноморской консорции «цистозира-церамиум» показано, что снижение обменной поверхности базифита при снижении гидродинамики и/или повышении эвтрофикации поч- ти полностью (до 85%) компенсирует возрастание поверхности эпифита (Завалко, 1988). Таким образом, продукция консорции «базифит-эпифит» достаточно постоянна, и не складывается механически из физиологических характеристик обоих компонентов, но имеет ярковыраженный интегрально-адаптивный характер, прежде всего — к трофности среды и гидродинамике.
Особый интерес представляют отношения с эпифитами и эндофитами у аскофиллу- ма. На его талломах практически всегда присутствует облигатный эпифит — багрянка Ро- lysiphonia lanosa, крайне редко встречающаяся на других фукоидах. Распределение поли- сифонии в поясе аскофиллума неравномерно: она не встречается у его нижней границы, которая менее всего осушается. Эпифит избегает литоральных ванн, хотя может присутствовать на растениях, окружающих эти ванны. Видимо, Polysiphonici lanosa требует некоторого определённого периода осушения для нормального развития. В экспериментах с меченым углеродом (14С) показано, что обмена между талломами хозяина и эпифита не существует, их фотосинтез независим (Harlin, Craigie, 1975). Однако какая-то аллелопатиче- ская связь, видимо, всё-таки существует: проростки полисифонии в культуре не способны сформировать нормальные ризоиды, пока в среду не будет добавлен экстракт талломов фукоидов. В природе эпифит в основном встречается или на поврежденных участках таллома базифита, или на местах отпавших рецептакулов. Наличие кусочков талломов аско- филлума или фукуса удлиняет жизнь апикальных фрагментов полисифонии в эксперименте в 1,5-2,5 раза. Видимо, приуроченность полисифонии именно к аскофиллуму определяется набором экологических факторов (прежде всего — «правильным» положением пояса аскофиллума в пространстве), а не какими-то специфическими биохимическими свойствами именно этого базифита (Garbary et al., 1991; Lining, Garbary, 1992).
Кроме того, в межклетном пространстве талломов как скального аскофиллума, так и его экад всегда присутствует аскомицет Mycophycias ascophylli, встречающийся также и у пельвеции. Присутствие гриба сопровождает всю жизнь аскофиллума, что даже побудило некоторых исследователей предположить, что аскофиллум представляет собой нечто вроде лишайника (Kohlmeyer, Kohlmeyer, 1972). Было обнаружено, что эндофит обитает и в талломах карликового аскофиллума (Коновалова, 2007).
Характер взаимоотношений М. ascophilli и A. nodosum до сих пор остается предметом дискуссии: разными авторами ассоциация трактуется как микоризоподобная или ли- хеноподобная. Не найдено никаких структур, соединяющих клетки хозяина и эндофита. Тем не менее, в эксперименте показано, что проростки A. nodosum без грибного компонента погибают максимум через год жизни, а инфицированные грибом лучше переносят осушение, а также продуцируют меньше ризоидов. A. nodosum с грибным симбионтом способен гетеротрофно усваивать олигосахариды, а чистая культура водоросли — нет. Т. е., гриб явно влияет на жизнедеятельность хозяина. Взаимоотношения компонентов лишайников и эндомикориз считаются умеренным паразитизмом, так как при этом образуются структуры, соединяющие клетки гриба и хозяина — гаустории или арбускулы (Белякова и др., 2006). Отсутствие подобных структур в ассоциации Ascophyllum — Mycophycias — единственный аргумент в пользу их мутуалистических отношений Конечно, Ascophyllum — не лишайник, он с очевидностью отличается от истинных морских лишайников (например, Verrucaria tavaresia) (Коновалова, 2007). Введён специальный термин, описывающий подобные отношения — «микофикобиоз» — постоянная симбиотическая ассоциация между морским грибом и морской водорослью, где водоросль определяет морфологию и местообитание (Kohlmeyer, Kohlmeyer, 1972).
Фукоиды обладают исключительно высокой экологической пластичностью. Наибольшую толерантность к факторам среды демонстрирует Fucus vesiculosus, имеющий самый обширный ареал — от берегов Испании до Арктического бассейна. Этот вид способен существовать в широком диапазоне солёности воды (от 6-7 %о до 36 %о), что позволяет ему обитать не только в типично океанических условиях, но и в эстуариях; он прекрасно переносит резкие перепады температуры и сильное иссушение; он довольно устойчив к антропогенному загрязнению. F. vesiculosus крайне изменчив морфологически, образует массу экологических форм. В Белом море известна сублиторальная f. giganteus, имеющая почти двухметровые талломы с широкими (до 4 см) ветвями (Возжинская, 1986). А на солёных маршах и в эстуариях этот фукус, напротив, представлен карликовыми формами. Ascophyllum nodosum образует несколько экологических форм и вариететов. В прибойных местах на скалистой литорали обычен карликовый вариетет A. nodosum var. minor, а в эстуариях и солёных маршах — неприкреплённые экады, дериваты скального аскофил- лума, образующие переходный ряд: A. nodosum ecad mackaii - A. nodosum ecad scorpi- oides - A. nodosum ecad muscoides (Максимова, Мюге, 2007). Первая экада ещё имеет немногочисленные рецептакулы с развитыми гаметангиями, вторая — очень редко несёт дегенеративные рецептакулы, а третья облигатно их лишена.
Фукоиды имеют колоссальную энергию размножения. Так, один таллом Sargassum продуцирует за сезон 100000 яйцеклеток (Suto, 1950). У черноморской Cystoseira barbata на одном слоевище образуется до 2200 рецептакулов, в которых развивается до 550 тыс. оогониев, в каждом из которых вызревает по одной яйцеклетке; у С. crinita — до 1400 рецептакулов и 400 тыс. оогониев (Калугина-Гутник, 1975). В периоды активного плодоношения беломорских фукоидов, особенно аскофиллума, можно наблюдать, как заливающая заросли приливная вода на короткое время изменяет цвет на оранжево-розоватый: это выходят в воду мужские гаметы — антерозоиды. По нашим данным, в период активного размножения A. nodosum концентрация антерозоидов в воде составляла 90-55000 кл./мл (0,36-216 мг С/м3), при этом доля антерозоидов в суммарной биомассе нанопланктона варьировала в разных точках прибрежья от 11% до 99%, составляя в среднем 46%. В период плодоношения F. vesiculosus концентрация его антерозоидов в воде была значительно ниже и составляла не более 1880 кл./мл (6,8 мг С/м3). По данным учёта в седиментаци- онных ловушках, за сутки на 1 м2 в зарослях макрофитов (при 100% проективном покрытии) выделяется в воду от 18 тыс. до 108 тыс. яйцеклеток A vesiculosus (0,33-2 мг С) (Максимова, Сажин, 2008).
Зиготы фукоидов быстро приклеиваются к субстрату полисахаридной слизью, и немедленно начинают формировать орган прикрепления — первичный ризоид. Уже через несколько часов после оплодотворения формируются проростки. Через две-три недели их можно различить невооружённым глазом даже в природе. Изначальная плотность их поселений очень велика: максимально наблюдавшаяся — 654 проростка F vesiculosus на 1 см2, в среднем — 80-230 на см2. Эту численность быстро снижают активно поедающие проростки литторины. Так, на одном из помеченных камней в трёх полях зрения бинокулярного микроскопа динамика численности проростков выглядела так: 28 августа — 235, 289, 416 проростков; 20 сентября — 235, 165, 320; 6 октября — 106, 121, 93. Видимо, литторины сначала сползаются на самые густые «заросли» (которые и несут самые существенные потери), и лишь потом переходят к более разреженным.
В зрелых сомкнутых зарослях плотность поселений существенно ниже, чем в ювенильных: у F vesiculosus — от 300-700 до 2 тыс. талломов на м2 (средняя и нижняя литораль), у A. nodosum — 250-300, у Pelvetia canaliculata — до 600 (Возжинская, 1986; Михайлова, Мохова, 2001). Растения максимальных возрастов (у фукуса — 9-11 лет, у аскофиллума— до 20 лет, у цистозир — 13-16 лет) встречаются единично. Ювенильные и стерильные растения всегда доминируют по численности, а фертильные — по биомассе (особенно в период плодоношения).
В отличие от вегетативной массы, генеративная продукция поступает в окружающую среду в относительно короткий срок. Выброс половых продуктов на короткий период полностью меняют облик нанопланктонного сообщества и служит в это время существенным источником пищи для многочисленных планктонных и бентосных организмов (Максимова, Сажин, 2008). Проростки также потребляют непосредственно, тогда как сами талломы — в основном в виде детрита. У разных видов рецептакулы в периоды размножения составляют 20-70% биомассы и даже более. После плодоношения рецептакулы фукусов интенсивно разрушаются, а у A. nodosum — быстро сбрасываются, образуя вдоль берега хорошо заметные скопления, внося существенный ежегодный вклад в прибрежную детритную сеть питания.
В среднем у фукоидов за год образуется по два дихотомических разветвления таллома. Возраст фукусов можно определить по формуле Y = (Х+1)/2 (если растение не ветвилось в первый год жизни) или Y = Х/2 (если растение образовало одну дихотомию в первый год жизни), где Y — возраст таллома, X — число дихотомий (Максимова, 1980). Можно определять возраст и по рядам воздушных пузырей, которые у Fucus vesiculosus закладываются раз в году весной, а у Ascophyllum nodosum дважды в год (Возжинская, 1971). Однако в разных экологических условиях эти признаки претерпевают существенные изменения: например, в эстуариях может образоваться 3-4 дихотомии за год, а в сильно прибойных местах воздушные пузыри иногда вообще не образуются. Так что определение возраста конкретного таллома в значительной степени зависит от опыта исследователя.
У фукуса растение последнего года жизни образует рецептакулы на всех разветвлениях и после плодоношения отмирает (Тиховская, 1948). Однако оставшаяся подошва может начать продуцировать новые вегетативные побеги — раметы, являющиеся клонами изначального «зиготного» проростка (генета). Раметы возникают и на подошвах повреждённых штормами талломов, и даже на маленьких подошвах проростков. Такой способ возобновления популяции у фукоидов преобладает над половым в соотношении примерно 10:1 (по численности) (Максимова, 2001).
Многие фукоиды — хозяйственно значимые, промысловые виды. Из них добывают ценные гелеобразователи — соли альгиновой кислоты. Альгинаты служат и весьма эффективными радиопротекторами. Например, при приёме внутрь кальций альгинатов активно замещает радиоактивный стронций, в том числе в костной ткани (до 95%). Литоральные водоросли охотно поедают домашние животные (и не только коровы и козы, но даже кошки и собаки), их используют для удобрения огородов и виноградников, при этом снижается поражение сельскохозяйственных культур грибковыми инфекциями. В настоящее время фукоиды переживают настоящий всплеск популярности в качестве косметических и оздоравливающих средств (SPA-процедуры, пищевые добавки), а в Интернете можно найти массу проектов по использованию саргассов из Саргассова моря для производства этанола.
Еще по теме Классификация морских донных растительных сообществ:
- Сообщества морских макрофитов[‡‡‡‡‡]
- Растительность морских побережий
- Классификация типов растительности
- 13.1.3 Свет в растительном сообществе
- Структура растительных сообществ
- Формирование и динамика растительных сообществ
- Общие сведения и классификация токсинов растительного происхождения
- РАСТИТЕЛЬНЫЕ СООБЩЕСТВА ДЛЯ ПЛОДОВОГО САДА В УСЛОВИЯХ УМЕРЕННОГО КЛИМАТА
- Потребители донных органических отложений.
- Продуктивность сообществ и жизненные стратегии водорослей. Морфофункциональный подход к изучению сообществ макрофитов
- СОСТАВ СООБЩЕСТВ И КОМПЛЕКСЫ СООБЩЕСТВ
- Рифовые сообщества Особенности рифовых сообществ
- Морские перья
- Гетеротрофные сообщества