Растворение золы
и фильтр несколько раз горячей дистиллированной водой. Охлаждённый раствор довести до метки водой, закрыть пробкой, взболтать.
В полученном растворе определяют содержание калия на пламенном фотометре, кальция и магния комплексонометрически. Фосфор можно определить, фотометрически, если безупречно проведено озоление растительного материала. Мокрое озоление растительного материала по К. Гинзбург и определение азота, фосфора, калия из одной навески
В основу метода положены реакции гидролиза и окисления органических веществ растений смесью серной и хлорной кислот в соотношении 10:1, при нагревании. Основным окислителем является хлорная кислота {НСЮ4).
Везазотистые органические вещества окисляются до воды и углекислоты, высвобождая зольные элементы в виде оксидов. Азотсодержащие органические соединения гидролизуются и, в конечном счёте, окисляются до воды и углекислоты, освобождают азот в виде аммиака, который немедленно связывается серной кислотой. Таким образом, в растворе находятся зольные элементы в виде оксидов и азот в форме сернокислого аммония и аммонийной соли хлорной кислоты.
Метод мокрого озоления исключает потери азота, фосфора и калия в виде их оксидов, так как растительное вещество озоляется при температуре 332°С. Это температура кипения серной кислоты, у хлорной кислоты значительно меньшая температура кипения - 121°С.
Необходимо помнить, что при добавлении избытка хлорной кислоты в процессе озоления происходят значительные потери азота (до 50 %). Ход анализа Навеску размолотого воздушно-сухого растительного материала 0.2 - 0.5 г, взятую на аналитических весах с точностью до ± 0001 г, помещают в колбу Кьельдаля. Навески в колбах Кьельдаля заливают смесью серной и хлорной кислот в объёме 5.0 - 10.0 мл (соотношение 10:1) и тщательно перемешивают круговым вращением колбы, осторожно встряхивая. Оставляют колбы в лотке на 1.5-2 ч. (можно на ночь) для первичного озоления растительного материала при комнатной температуре. После этого колбы устанавливают на нагревательные приборы для дальнейшего озоления и нагревают на слабом огне до образования однородной коричнево-бурой массы. Температуру озоления повышают до слабого кипения раствора и продолжают озоление до полного его обесцвечивания.
Если раствор продолжает оставаться окрашенным в жёлтый или тёмно-бурый цвет, колбы охлаждают, добавляют 2-3 капли хлорной кислоты и продолжают нагревание. Количество хлорной кислоты, добавленное сверх указанной нормы, ускоряет процесс озоления, но приводит к существенным потерям азота в пробе.
Параллельно проводят контрольное озоление исходных реактивов без растительной пробы в аналогичном режиме.
После окончания озоления колбы Кьельдапя охлаждают на воздухе, затем в них приливают 10 мл дистиллированной воды и после перемешивания содержимого вновь охлаждают, доливают около 60 мл горячей дистиллированной воды.
Раствор из колбы Кьельдаля количественно переносят в мерную колбу на 100 мл. При этом колбу Кьельдаля многократно промывают небольшими (около 5 мл) порциями горячей дистиллированной воды, сливая промывные воды в мерную колбу. После охлаждения объём в мерной колбе доводят до метки дистиллированной водой и после этого, закрыв пробкой перемешивают.
В растворе определяют общий азот, фосфор и калий по соответствующим методикам. Реактивы Серная кислота концентрированная (d=1.89) Хлорная кислота концентрированная.
Ход анализа После мокрого озоления растительного материала по методу Гинзбург из мерной колбы на 100 мл (ориентировочное окрашивание провести с одной колбой, взяв 5 мл раствора) взять 5-10 мл испытуемого раствора в мерную колбу объёмом 50 мл. Прилить 20-25 мл дистиллированной воды. Нейтрализовать раствор (под тягой, в специально отведённой комнате для работы с аммиаком) 10 %-ным раствором аммиака до слабо розовой окраски по фенолфталеину, снять окраску добавлением нескольких капель 1%-ного раствора серной кислоты. Внести пипеткой 1 мл раствора молибденовокислого аммония, хорошо взболтать. Добавить 3 капли раствора хлористого олова, снова тщательно взболтать, довести до метки дистиллированной водой. Через 10-15 минут колориметрировать при тех же условиях, при которых строился калибровочный график. Расчёт
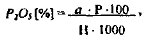
где: а - мг PjOs по графику; 100 - для выражения данных в процентах; Р - разведение; 1000 - для приведения данных к одним единицам; Н - навеска воздушно-сухого вещества, г.
4.7.3. Форма записи
|
I Вариант |
№ |
разведен |
отсчёт по |
Р205. мг по |
|
|
1 опыта |
колбы |
не |
ФЭК |
графику |
% |
Реактивы и построение калибровочного графика см. стр. 27-28.
4.8. Определение общего азота по Къельдалю
Азот, поглощённый растением в процессе вегетации, распределяется по органам растений неравномерно. Более высокое содержание азота наблюдается в генеративных органах, особенно в
зерне, и меньше его концентрация в листьях, стеблях, корнях, корнеплодах, очень мало в соломе. Общий азот в растении представлен двумя формами: азотом белковым и азотом небелковых соединений. К последним относится азот, входящий в состав амидов, свободных аминокислот, нитратов и аммиака.
Содержание белка в растениях определяют по количеству белкового азота Содержание белкового азота (в процентах) умножают на коэффициент 6.25 при анализе вегетативных органов и корнеплодов и на 5.7 при анализе зерна.
На долю небелковых форм азота приходится в вегетативных органах 10-30 % от общего азота, а в зерне не более 10%. Содержание небелкового азота к концу вегетации снижается, поэтому в производственных условиях, особенно при анализе кормов, долей небелкового азота пренебрегают. Определяют в этом случае общий азот (в процентах) и его содержание пересчитывают на белок. Этот показатель называется "сырой белок", или протеин.
Принцип метода. Навеску растительного материала озоляют в колбе Кьельдаля концентрированной серной кислотой в присутствии одного из катализаторов: металлического селена, перекиси водорода, хлорной кислоты и т.п. Температура озоления 332°С. В процессе гидролиза и окисления органической массы азот в колбе сохраняется в растворе в виде сульфата аммония. Для освобождения аммиака используют 40%-ный раствор щёлочи:
{NH{)2SOj + 2NaOH -+NojSOj + 2 NH4OH
Отгон аммиака ведут в аппарате Кьельдаля при нагревании и кипении раствора.
В кислой среде нет гидролитической диссоциации сульфата аммония, парциальное давление аммиака равно нулю. В щёлочной среде происходит смещение равновесия, и в растворе образуется аммиак, который при нагревании легко улетучивается.
2NHt()H = 2A7/3t • 2НгО.
Аммиак не теряется, а переходит по холодильнику вначале в виде газа, а затем, конденсируясь, каплями попадает в приёмник с титрованной серной кислотой и связывается ею, вновь образуя сернокислый аммоний:
2NH, + HjSO = (NH4hS04.
Избыток кислоты, не связанный с аммиаком, отгитровывается щёлочью точно установленной нормальности по комбинированному индикатору или по метилроту. Ход анализа На аналитических весах взять навеску растительного материала « 0 3-0 5 ± 0 0001 г с помощью пробирки (по разности между весом пробирки с навеской и весом пробирки с остатками материала) и, надев на конец пробирки резиновую трубку длиной 12- 15 см, осторожно опустить навеску на дно колбы Кьельдаля.
Прилить в колбу небольшим цилиндром 10-12 мл концентрированной серной кислоты (d=1.84). Равномерное озоление растительного материала начинается уже при комнатной температуре, поэтому залитые кислотой навески лучше оставить на ночь. Поставить колбы на электроплитку или специальную установку и проводить постепенное сжигание вначале на слабом огне (положить асбест) затем на сильном, периодически осторожно взбалтывая. Когда раствор станет однородным, прибавить катализатор (несколько кристаллов селена или несколько капель перекиси водорода) и продолжить сжигание до полного обесцвечивания раствора.Катализаторы. Повышению температуры кипения серной кислоты и ускорению озоления способствует применение катализаторов. В различных модификациях метода Кьельдаля используют металлические ртуть и селен, сернокислый калий, сернокислую медь, перекись водорода. Использовать для сжигания в качестве катализатора хлорную кислоту отдельно илн в смеси с серной кислотой не рекомендуется. Скорость окисления материала обеспечивается в этом случае не за счёт повышения температуры, а за счёт быстрого выделения кислорода, что сопровождается потерями азота при озолении. Отгон аммиака. После окончания сжигания колбу Кьельдаля охлаждают и в неё осторожно приливают по стенкам дистиллированную воду, перемешивают содержимое и ополаскивают горлышко колбы. Первую порцию воды наливают до горлышка и количественно переносят в круглодонную колбу ёмкостью 1 л. Колбу Кельдаля ещё 5-6 раз промывают небольшими порциями горячей дистиллированной воды, сливая каждый раз промывные воды в отгонную колбу. Наполняют отгонную колбу промывными водами до 2/3 её объёма и добавляют 2-3 капли фенолфталеина. Малое количество воды затрудняет парообразование при отгоне, а большое может вызвать переброс кипящей воды в холодильник. В коническую колбу или химический стакан ёмкостью 300- 400 мл (приёмник) наливают из бюретки 25-30 мл 0.1 н. HjS04 (с точно установленным титром), добавляют 2-3 капли индикатора метилрота или реактива Гроака (лиловая окраска).
Кончик трубки холодильника погружают в кислоту. Отгонную колбу ставят на нагреватель и подсоединяют к холодильнику, проверяя герметичность соединения. Для разрушения сернокислого аммония и отгона аммиака используют 40 %-ный раствор щёлочи, взятый в таком объёме, который в четыре раза превосходит объём концентрированной серной кислоты, взятой при сжигании пробы (при Ю мл кислоты берут 40 мл щёлочи). Отгонную колбу прямо на нагревателе открывают, наклоняют, в левой руке удерживают колбу и пробку холодильника. В колбу по стенке приливают отмеренное количество щёлочи так, чтобы она опустилась вся на дно колбы, и пробку холодильника быстро закрывают. Это вызвано тем, что реакция взаимодействия щёлочи и сульфата аммония начинается и без нагревания, что приводит к потерям аммиака. Горлышко колбы нельзя по всей поверхности заливать щёлочью, так как пробка холодильника выскочит при кипячении. Закрытую колбу осторожно и тщательно взбалтывают круговыми движениями, при этом в стакан-приёмник проскакивают первоначально пузырьки воздуха. Раствор в колбе сначала становится красного цвета, а затем темнеет, и при нагревании появляется объёмный осадок. Включают нагреватель и холодильник и приступают к отгону аммиака. Через 20-25 мин после начала отгона опускают стакан-приёмник так, чтобы раствор аммиака из холодильника стекал по стенке стакана. Кипение в отгонной колбе должно быть равномерным и достаточно интенсивным, иначе кислота из стакана будет засасываться в холодильник за счёт перепада внутреннего и наружного давления газов. Если засасывание началось, надо усилить нагрев отгонной колбы и вынуть конец трубки холодильника из раствора кислоты, для этого опустить стакан-приёмник. Отгон считать законченным, когда содержимое отгонной колбы испарится до 1/3 первоначального объёма. Полноту отгона аммиака проверяют универсальным индикатором, лакмусом или реактивом Несслера, для чего берут несколько капель из холодильника на индикаторную бумагу или в пробирку, куда добавлен реактив Несслера. Он даёт с аммиаком жёлтоё окрашивание.Если в процессе отгона жидкость в приёмнике изменит окраску, необходимо добавить точно фиксированное количество 0.1 н. H2SO4 (20 мл), так как первоначального объёма кислоты не хватило для связывания аммиака. По окончании отгона, носик холодильника споласкивают дистиллированной водой из промывалки в приёмник. Содержимое приёмника титруют 0.1 н. раствором едкого калия, перемешивая осторожно стеклянной палочкой, до перехода
окраски метилового красного в бесцветную, а по реактиву Гроака от лиловой в светло-зелёную. Здесь интенсивность окраски зависит от количества индикатора.
Количество аммиака находят по разности между количеством кислоты в приёмнике, первоначально прилитой, и количеством кислоты, которая не связалась с аммиаком и оттитрована впоследствии щёлочью.
4.8.2. Расчёт
Содержание общего азота: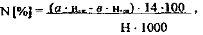
где: a - объём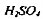 в приёмнике, мл ; н.к- нормальность
в приёмнике, мл ; н.к- нормальность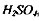
мгэкв, Ь - объём щёлочи, израсходованный на титрование, мл; н.щ- нормальность щёлочи, мг экв; 14 - атомная масса азота; Н - иавеска, г; 1000 - коэффициент пересчёта мг в г.
4,8,3. Форма записи
|
№ образца |
масса пробирки + навеска, г |
масса пробирки, г |
на вес ка, г |
объем h2so4, мл, приемн ик |
объем NaOH, мл |
Нк |
Нщ |
N, % |
4.8.4. Реактивы
1. Серная кислота концентрированная (d=1.84)
2.40 %-й раствор щёлочи. Селен металлический порошок. 0.1 н. раствор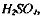 готовится из фиксанала. 0.1 н. раствор NaOH или КОН, готовится из фиксанала. Индикатор Гроака, комбинированный, при pH 5.5 - чёткое изменение фиолетового цвета на зелёный.
готовится из фиксанала. 0.1 н. раствор NaOH или КОН, готовится из фиксанала. Индикатор Гроака, комбинированный, при pH 5.5 - чёткое изменение фиолетового цвета на зелёный.
Приготовление:
А - 0.15 г метиленового красного растворяют в 102 мл этилового спирта-ректификата;
Б - 0.05 г метиленового голубого растворяют в 5 мл дистиллированной воды. Смешанный индикатор хранят в склянке из тёмного стекла.
Еще по теме Растворение золы:
- Определение в растениях "сырой" золы
- Растворение (лизис) микроорганизмов бактериофагами
- ОПРЕДЕЛЕНИЕ СЫРОЙ ЗОЛЫ (ГОСТ 13979.6-69)
- РАСТВОРЕННЫЕ В ВОДЕ ГАЗЫ
- ЗОЛЬНЫЕ МАКРОЭЛЕМЕНТЫ
- СОЛЕВОЙ СОСТАВ ВОДЫ
- Соленость.
- Определение марганца в крови перйодатным методом.
- ПРИГОТОВЛЕНИЕ И ХРАНЕНИЕ ТОЧНЫХ РАСТВОРОВ
- ОБНАРУЖЕНИЕ МИКРООРГАНИЗМОВ, УЧАСТВУЮЩИХ В ПРЕВРАЩЕНИЯХ ФОСФОРА, СЕРЫ, ЖЕЛЕЗА И МАРГАНЦА
- Исследование способности к разложению фосфатову штаммов псевдомонад и азотобактера
- Связывание токсикантов клетками крови.
- Обработка семян микроэлементами
- ГИДРОЛОГИЧЕСКАЯ РОЛЬ БОЛОТ
- ИСТОКИ АГРОХИМИИ