Деревья в семействах с преобладанием трав
Семейство сложноцветные (Compositcie, или Asteraceae) — одно из крупнейших семейств покрытосеменных, насчитывающее более 1000 родов и более 20000 видов. Встречаются они везде: от арктических пустынь до тропических лесов, от морских побережий до альпийских снегов.
Большинство сложноцветных — травы, реже кустарники, и лишь иногда — деревья. Независимое и неоднократное образование жизненной формы «дерево» возможно у сложноцветных, вероятно, благодаря тому, что у многих видов стебель частично одревесневает, что хорошо знают те, кто пробовал скосить лопух {Arctium sp.): его ствол гораздо прочнее ствола одноразмерной ели — т. е. семейство преадаптировано к образованию деревьев. Но образование жизненной формы «дерево» происходит лишь при отсутствии в экосистеме деревьев других таксонов, для которых эта жизненная форма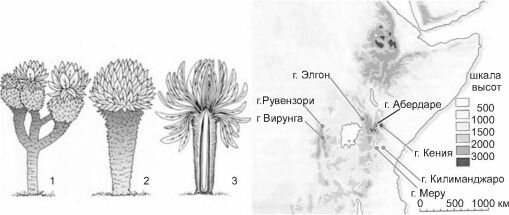
Рис. 4.12. Сложноцветные деревья вершин центральноафриканских гор.
1,2 — общий вид ветвящейся и неветвящейся формы Senecio, 3 —дерево в разрезе, видны основания старых листьев, создающие «шубу», предохраняющую ствол от заморозков. По Сох, Moore (2000). На карте — центральноафриканские горы со сложноцветными деревьями рода Senecio. 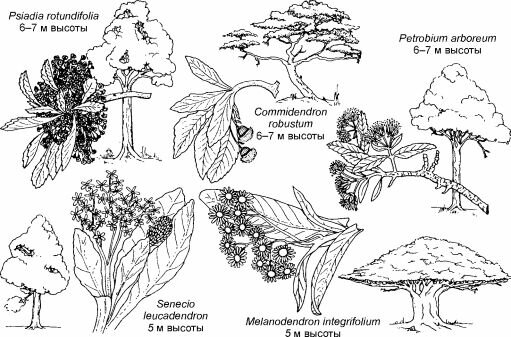
Рис. 4.13. Сложноцветные деревья о-ва Святой Елены. По Сох, Moore (2000).
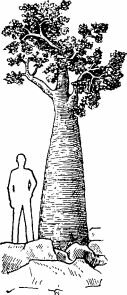
Рис. 4.14. Dendrosicyos socotranus. По Денисовой (1981).
обычна. Такие условия возникли на вершинах центральноафриканских гор, возраст которых не превышает 1 млн. лет (рис. 4.12). Местная весьма богатая тропическая флора по каким-то причинам не смогла создать деревья, способные выносить временные заморозки.
Дефицит деревьев был заполнен сложноцветными в результате образования видов рода Senecio (к нему принадлежат обычные в средней полосе России крестовники) 11 видами подрода Senecio (Dendrosenecio), на некоторых вершинах до трёх эндемичных видов. Молекулярный анализ показал, что внешнее сходство деревьев разных гор конвергентно, каждый из видов образовался из местных (Knox, Palmer, 1995), т. е. симпатрично.На острове Святой Елены (место ссылки Наполеона) местная флора была почти полностью самобытной и своеобразной, дефицит деревьев был заполнен сразу пятью видами (рис. 4.13) сложноцветных, в лесах преобладал Commidendron robus- tum, было здесь и дерево рода Senecio.
На Галапагосских островах представители эндемичного рода сложноцветных Scalrsia — деревья высотой более 20 м при диаметре ствола 25-30 см.
На близлежащих островах Хуан Фернандес имеется целых три древесных рода сложноцветных: Robinsonia, Rhetino- dendron и Dendroseris, а также три древесных вида рода марь Chenopodium (Chenopodiaceae), к которому принадлежат обычные в средней полосе огородные сорняки.
На о. Сокотра, расположенном в Аденском заливе, дефицит деревьев заполнен огуречным деревом Dendrosicyos soco- tranus — представителем семейства тыквенных, близким к дыне (рис. 4.14).
Е.С. Pielou считает такие деревья «живыми ископаемыми» «почти несомненно старше, чем острова, которыми ныне ограничен их ареал» (Pielou, 1979: 200). Из текста неясно, на чём основано это утверждение. Возможно, просто на том, что она просто считает жизненную форму «дерево» древнее жизненной формы «трава» (мнение широко распространённое), но несомненно, что в данном случае это не так. Ареал этих видов ограничен островами не «ныне», наоборот, из приведённых примеров ясно, что жизненная форма «дерево» образуется из местных видов каждый раз, когда экосистеме в ней испытывает дефицит.
Капская флора
Пожалуй, один из наиболее ярких примеров эндемизма таксонов разного ранга, вплоть до очень высокого, даёт Капская флора юга Африки.
В этой флоре только покрытосеменные представлены 6 эндемичными семействами. 19,5% обитающих там родов — эндемы. Необычайно высоко и видовое богатство флоры — 8500 видов, из которых 90% — эндемы (Dyer, 1975; Goldbaltt, 1978). До недавнего времени это считали достаточным для выделения её в отдельное царство (Алёхин, 1944; Алёхин и др., 1961; Вальтер, 1968; Тахтаджян, 1970 и мн. др.). Однако новые данные по биогеографии и экологии заставляют иначе взглянуть на этот феномен. Согласно современным, представлениям капская флора сформировалась в условиях средиземноморского климата (сухое тёплое лето и влажная холодная зима). Другими такими же регионами являются само Средиземноморье (здесь специфические сообщества имеют местные названия: маквис, маки, маччия, гарри- га, фригана, шибляк), Калифорния (чаппараль), побережье Чили (маттораль), юго-запад Австралии (малли-скрэб) (рис. 4.15). В самой Южной Африке сообщества получили название финбош. Вместе эти пять регионов занимают менее 5% поверхности суши, но их флора включает 48250 видов покрытосеменных (20% земной флоры). Конечно, до некоторой степени, — это артефакт того, что благодаря прекрасному климату, именно здесь размещаются многие научно-исследовательские организации: описана достоверная зависимость между числом видов, известных лишь по гербарным образцам, от расстояния до ближайшего музея с гербарием (Wohlgemuth, 1993). Но это только до некоторой степени объясняет наблюдаемый феномен, основную причину столь высокого видового богатства следует искать в условиях существования экосистем этих районов и в процессах их формирования.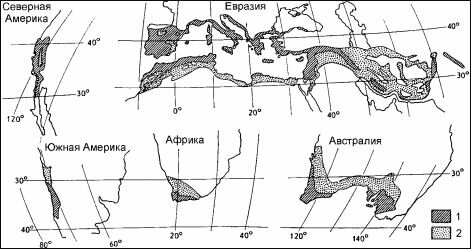
Рис. 4.15. Области средиземноморского климата.
1 — средиземноморский тип климата; 2 — аридные области, преимущественно с зимними дождями. По Walter (1968).
«Своеобразие флоры Капской провинции обусловлено распространением следующих семейств и таксонов, встречающихся только на полуострове Кейп или имеющих здесь свой основной ареал.
Семейства: Proteaceae, Restionaceae, Репаеасеае, Bruniaceae. Geissolomaeeae, Stilbaceae, Retzia- ceae, Grubbiaceae.
Трибы: Diosmeae среди Rutaceae.
Роды: Erica (почти 600 видов), Cliffortia (розоцветные, со 108 видами), Muraltia (истодовые, 115 видов), Metalasia и Stoebe (сложноцветные), Roridula (2 вида, семейство Byblidaceae, к которому относятся еще только 2 австралийских вида Byblis). Все протейные, помимо вида Brabejum stellatifo- lium, относятся к подсемейству Persoonioideae. Семейство богато представлено и в Австралии, но другими родами. В Африке широко распространен самый примитивный род Faurea. Из 100 видов Protea только немногие встречаются за пределами Капской провинции.
Из семейства Restionaceae один только род Restio представлен в Южной Африке 117 видами (1 на Мадагаскаре, 27 в Австралии)» (Вальтер, 1968, цит. по: 1972: 157).
В олигоцене все эти регионы были покрыты влажными субтропическими лесами. В миоцене их климат изменился с влажного субтропического на средиземноморский. В первую очередь это привело к существенному уменьшению суммарного количества осадков и их перераспределению в течение года. Старые экосистемы не могли существовать в новых условиях, поэтому возникли совершенно новые, способные существовать в условиях дефицита влаги в наиболее жаркий период года. В настоящее время экосистемы районов со средиземноморским климатом образованы жестколистной, в значительной степени ксе- рофильной кустарниковой растительностью с большим количеством суккулентов. Эти черты выражены в разной степени в разных местах: в Австралии и Средиземноморье велика роль деревьев, в Южной Африке много суккулентов и т. д. Кроме сходства климатических условий и повышенного видового разнообразия эти сообщества объединяет то, что для них характерны частые пожары. Поэтому растения этих флор имеют специальные адаптации к пожарам и, до некоторой степени, их провоцируют (среди них увеличена доля видов, имеющих повышенное содержание легко воспламеняющихся соединений типа эфирных масел) (Жерихин, 1995). Очевидно, что образование таких экосистем из влажных субтропических лесов потребовало резких перестроек, в результате которых сформировались совершенно новые сообщества с сильно отличающимся набором ниш.
В Европе, Америке и Австралии новообразующиеся экосистемы граничили с районами (например, горными), где обитало много видов, преадаптированных к новым условиям. Эти виды послужили основой формировавшихся экосистем, что привело к значительному сходству их флор с соседними. Капская же флора была вынуждена образовываться заново. Своеобразная часть биоты была образована лишь немногими исходными формами, что привело к созданию большого количества эндемичных видов и родов, относящихся к немногим семействам, тогда как остальная биота сравнительно мало отличается от соседних. Так, зоологи никогда не придавали капскому региону ранга выше подобласти, хотя образование специфических экосистем привело к образованию эндемов и среди животных: эндемичные рода есть среди позвоночных (земляной волк Proteles), но особенно много их среди насекомых (жужелица Axinidium, большинство родов трибы жужелиц Сге- oidosterini, многие чернотелки, долгоносики и др.) (Крыжановский, 1976, 2002). Весьма специфична и пресноводная биота региона, в которой есть даже эндемичные семейства (Banarescu, 1992). Более того, даже среди покрытосеменных в группах, не давших вспышки эндемизма, отличие капской флоры от соседних весьма невелико. Это показало, например, сравнение лилейных разных районов Земли (рис. 4.16).Помимо прочего, из вышесказанного следует, что нет веских биологических причин рассматривать Капскую флору как самостоятельное царство. Она лишь интересная провинция. Самостоятельным царством капский регион можно считать только при чисто формальном подходе, опирающимся на арифметический подсчёт эндемичных таксонов и игнорирующем биологический смысл выделяемых биогеографических регионов. Стремление придать биологическое содержание биогеографическим выделам и их рангу получает в последнее время всё большее распространение. В частности понизить ранг Капского
Рис. 4.16. Сходство Liliiflorae разных регионов.
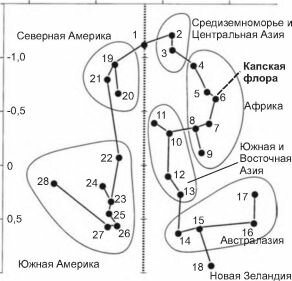
1 — север Голарктики; 2 — Средиземноморье; 3 — Средний Восток и Центральная Азия; 4 — Сахаро-арабский регион; 5 — Намиби-Кару; 6 — мыс Доброй Надежды; 7 — присахарский регион, восток и юг Центральной Африки (преимущественно безлесные ландшафты); 8 — тропический дождевой лес Западной Африки; 9 — Мадагаскар; 10 — Индия; 11 —восточный Китай; 12 — Юго-Восточная Азия; 13 — Малайзия; 14 — Папуа (Новая Гвинея); 15 — Северная и Центральная Австралия; 16 — юго-запад Австралии; 17 — Центральная Австралия; 19 — Скалистые горы; 20 — восток Северной Америки; 21 — юго-запад Северной Америки; 22 — Центральная Америка; 23 — восток Бразилии; 24 — аргентинская пампа; 25 — Амазония; 26 — Гвианское нагорье на севере Южной Америки; 28 — Патагония.
По осям значения, полученные методом многомерного шкалирования. По Conran (1995).фитогеографического региона до провинции предлагают уже многие (Cowiling et al., 1996; Разумовский, 1999; Сох, Moore, 2000).
Паратетис
Для Каспийской и Аральской биот и биот распреснённых районов Азово-Черномор- ского бассейна (и некоторых пресных и солоноватых водоёмов Европы и Северной Африки) характерен высокий эндемизм. Эти биоты — остатки биоты Паратетиса (см. главу 1).
Современное население этого района образует три, описанные в главе 1, биоты: пресноводную, солоноватоводную и «морскую». Пресноводная биота сильно обогатила фауну рек бассейна, в первую очередь Волги, а также рек Азово-Черноморского бассейна: Dreissena, Ampharetidae, Corophiidae и др. Солоноватоводная биота населяет Северный Каспий и существует в виде рефугиумов в устьях рек Азово-Черноморского бассейна, отдельные представители обитают в рефугиумах в других солоноватоводных водоёмах от Марокко до Балтийского моря. «Морская» фауна вместе с несколькими недавними средиземноморскими вселенцами (Cercistoderma, Mytilaster, Abra, Nereis и др.) образовала «морскую» экосистему Среднего и Южного Каспия и Арала.
«По мнению К.А. Киселевича (1923), многочисленные виды и подвиды каспийских сельдей произошли от одного вида, a G.O. Sars (1927) и А.Н. Державин (1951) пришли к выводу, что все каспийские Cuma- сеа (только в Каспии 7 родов и 17 видов — ИЖ) произошли от одной прародительской формы» (Карпинский, 2002: 36). По моему мнению все каспийские полихсты-Ampliare- tidae произошли от одного вида.
Л.А. Невесская с соавт. (2006) проанализировали развитие фаун моллюсков в Пара- тетисе с раннего олигоцена до настоящего времени (за последние 35 млн. лет) (рис. 4.17). Каждый раз при повышении солёности (что всегда было связано с установлением связи с океаном) биота Паратетиса становилась сходной с биотой районов, с которыми устанавливалась связь.
При снижении солёности, вызванной частичной или полной изоляцией, происходила вспышка видообразования. За анализируемый период зарегистрировано 7 таких вспышек, в каждой из которых за короткий период времени возникало большое число видов (десятки и сотни) и родов (десятки). Среди двустворчатых моллюсков это особенно было характерно для Limnocardiinae, куда относится и Cerastoder- та — исходный для подсемейства род. Только в этом подсемействе за проанализированный период образовалось более 700 видов 68 родов. Видообра-
LYMNOCARDIINAE
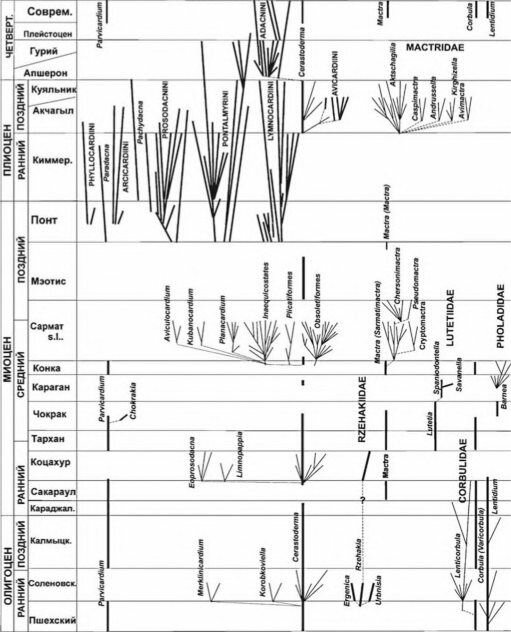
Рис. 4.17. Схема филогении и стратиграфического распространения основных семейств и родов двустворчатых моллюсков, давших вспышки видообразования в бассейнах Восточного Паратетиса
По JI.A. Невесскаой и др. (2006).
1 — исходный морской род; 2 — появление эндемичных видов: 3 — появление эндемичных родов.
зование во время вспышек происходило гораздо интенсивнее: только в Didacna в плейстоценовом Понто- Каспии за 600 тыс. лет образовалось 70 видов. В других частях Паратетиса вспышки давали другие таксоны: в Паннонском озере (западная часть Паратетиса) в миоцене-плиоцене только Dreissenidae обитало 130 видов (Geary et. al., 2000). Во всех случаях видовой состав перед вспышками видообразования был очень беден, что с экологических позиций означает наличие неиспользуемых ресурсов.
Палеотолог Л.Ш. Давиташвили, характеризую фауну моллюсков Сарматского века Понто-Каспия, пишет: «Здесь мы видим множество... разнообразнейших форм, многие из них нам пришлось бы выделить в особые роды, если бы мы следовали примеру зоологов, изучающих современную фауну моллюсков» (1933: 158).
В периоды интенсивного видообразования появлялись рода, сильно уклонявшиеся от исходных форм Limnocardiinae. В том числе некоторые становились эпибентосными фильтраторами, одни из них лежали на грунте вниз макушкой, сильно сдвинутой вперёд, другие прикреплялись биссусом к рифам. Некоторые Limnocardiinae переходили к жизни на жидких илах, их раковины становились тонкими, на раковинах снаружи могли возникать шипы, помогавшие держаться на поверхности грунта. Дрейссены, ныне исключительно эпибентические фильтраторы, образовывали ин- фаунных детритофагов (рис. 6.19). Даже такая узкоспециализированная группа как камне- точцы фоласы (рис. 2.11) в Конкский век дали виды, живущие свободно на мягких грунтах. Появление адаптаций, не характерных для остальных видов данного таксона,
- S. Myers (1960), назвал «supralimital specialization», А.И. Кафанов (1991) — «запредельной специализацией». Очевидно, что в таких случаях происходит попытка освоения нового адаптивного пространства, т. е. ароморфоза.
Представление о том, как и с какой скоростью происходило видообразование в водоёмах Паратетиса даёт изучение современных изменений биоты Аральского моря.
Еще по теме Деревья в семействах с преобладанием трав:
- БУМАГА ИЗ ТРАВ И ДЕРЕВЬЕВ
- Семейство ТаксодиевыеМамонтово дерево
- УДОБРЕНИЕ МНОГОЛЕТНИХ ТРАВ
- УДОБРЕНИЕ ЛУГОВ, ПАСТБИЩ И СЕЯНЫХ ТРАВ В ПОЛЕВОМ СЕВООБОРОТЕ
- КАПУСТНОЕ ДЕРЕВО
- ЖЕЛЕЗНЫЕ ДЕРЕВЬЯ
- ДЕРЕВЬЯ С ЦВЕТНОЙ ДРЕВЕСИНОЙ
- КОЛБАСНОЕ ДЕРЕВО
- ЗЕМЛЯНИЧНОЕ ДЕРЕВО
- «ГОВОРЯЩИЕ» ДЕРЕВЬЯ
- ДЕРЕВО, КОТОРОЕ ЗНАКОМО С МАТЕМАТИКОЙ
- ДЕРЕВО-РОЩА
- ДЕРЕВО-АПТЕКА
- КОНФЕТЫ НА ДЕРЕВЬЯХ
- ВСЯ ЖИЗНЬ НА ДЕРЕВЬЯХ
- МОЛОКО, КОТОРОЕ РАСТЕТ НА ДЕРЕВЬЯХ
- Моя специальность — фруктовые деревья
- ХЛЕБ, КОТОРЫЙ РАСТЕТ НА ДЕРЕВЬЯХ