Методы молекулярной диагностики болезней картофеля
Основной прорыв произошел с внедрением в диагностику метода иммуно-ферментного анализа (ИФА), одним из наиболее распространенных вариантов которого является так называемый ELISA-тест (Enzyme-Linked ImmunoSorbent Assay, ELISA). Метод позволил не только увеличить чувствительность анализа, но и сократить время тестирования до нескольких часов. ELISA и по сей день является наиболее распространенным и широко используемым методом анализа растительного материала для диагностики и идентификации патогенов. При постановке ИФА тестов используется целый ряд технологий и модификаций с использованием биотиниликованных и конъюгированных с щелочной фосфатазой или пирофосфотазой антител в так называемых прямом методе, двойном и тройном сандвичах и др.
Диагностика фитопатогенов методом ИФА хорошо зарекомендовала себя в широкомасштабных рутинных тестированиях растительного материала, однако метод обладает не всегда удовлетворительной специфичностью, диагностируя зачастую не отдельные патогены, а целые группы и не позволяет четко идентифицировать конкретные изоляты и штаммы. Следует иметь в виду и тот факт, что от партии к партии качество и специфичность получаемых антител может довольно существенно разниться. В настоящее время специфичность ИФА в значительной степени увеличена за счет использования моноклональных и рекомбинантных антител. Использование модификации метода ИФА - процедуры иммуноферментного анализа отпечатков образцов растительных тканей на нитроцеллюлозной мембране (tissue print-ELISA) - также обеспечивает высокую специфичность, хотя чувствительность этого метода недостаточна для использования в случае детекции ряда латентных бактериальных инфекций.
Другим серологическим методом, применяемым для диагностики фитопатогенов, в частности бактерий, является метод проточной фотометрии (Alvarez, 2001), хотя высокая стоимость используемой в этой процедуре аппаратуры существенно ограничивает его использование в реальной практике.
В настоящее время при анализе растительного материала возникает необходимость применения высокочувствительных и специфичных методов детекции, позволяющих диагностировать патогены в низкой концентрации, что особенно важно в случае контроля растительного материала на наличие карантинных патогенов. Поэтому в помощь, а сегодня все чаще на смену традиционным и серологическим методам, в практику контроля фитосанитарного состояния сельскохозяйственных растений и продуктов их переработки приходят молекулярные технологии. Это позволяет значительно повышать специфичность анализов
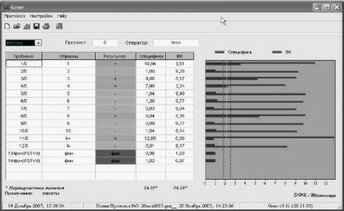
Рис. 4. Диагностика образцов картофеля с помощью диагностического набора ООО «АгроДиагностика» в формате FLASH на наличие инфещии, вызванной Y-вирусом картофеля.
1 - 10 - тестируемые образцы картофеля, 11 - положительный контрольный образец, 12 - отрицательный контрольный образец, 13 - 14 - фоновый контрольный образец. Из проанализированных образцов инфекция обнаружена в 1, 3, 4 и 8.
и обеспечивать чувствительность, в 10 - 100 раз превышающую чувствительность ИФА.
Современный метод высокоэффективного тестирования патогенов, в том числе и фитопатогенов, основан на полимеразной цепной реакции (ПЦР) (Bartlett, Stirling, 2003). Простота, высокие чувствительность и специфичность, хорошая воспроизводимость результатов анализов быстро превратили этот подход в один из наиболее перспективных диагностических методов. В отличие от традиционных и серологических методов анализа, дающих только опосредованное свидетельство наличия инфекции (например, сведения о наличие белков-антигенов диагностируемых патогенов), метод ПЦР напрямую доказывает присутствие возбудителя инфекции, специфически выявляя наличие конкретной последовательности нуклеиновой кислоты (ДНК или РНК) обнаруживаемого патогена. Кроме того, метод ПЦР, благодаря своей высокой чувствительности, позволяет выявлять единичные копии геномов патогенов, обнаруживая тем самым их наличие тогда, когда другими методами (иммунологическими, бактериологическими, микроскопическими) это сделать практически невозможно. Особенно эффективен метод ПЦР для диагностики трудно культивируемых, некультивируемых и скрыто существующих форм микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях: ПТТР- технологии, как правило, позволяют избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях. Кроме того, использование метода ПЦР позволяет значительно сократить время анализа образца. За счет автоматизации процесс амплификации занимает всего 1-2 часа, а с учетом предшествующей пробоподготовки и регистрации результатов анализа, весь процесс занимает не более 4 часов. Помимо всего выше перечисленного, существенным достоинством метода является возможность осуществлять количественное определение возбудителя в модификации метода ПЦР в реальном времени.
Высокая чувствительность ПЦР является как преимуществом, так и недостатком метода, создавая ряд проблем, одной из которых является высокая вероятность появления ложноположительных и ложноотрицательных данных. Кроме того, корректность проводимых ПЦР-тестов в значительной степени зависит от адекватности методов выделения нуклеиновых кислот из растительного материала; чувствительность детекции зависит от влияния присутствующих в растительном материале ингибиторов ПЦР.
Все это усложняет процедуру ПЦР-детекции, требуя постановки дополнительных контрольных тестов или использования модификаций метода ПЦР. При молекулярной диагностике фитопатогенных грибов, вирусов и бактерий применяют следующие модификации ПЦР: метод конкурентной ПЦР (Mauchline et al., 2002), кооперативной ПЦР (Co-PCR) (Olmos et al., 2002), ПЦР-гибри- дизация in situ с использованием флуоресцентных зондов (Lopez et al., 2003), мультиплексная ПЦР (Rigotti, Gugerli, 2007), метод множественной (или групповой) мультиплексной ПЦР (multiplex nested RT-PCR) (Morris et al., 2001, Ciapina et al., 2004), метод ПТ TP в реальном времени (real-time PCR) (Norman et al., 2002).
Наиболее перспективным для диагностических лабораторий, проводящих рутинные анализы, являются методы ПЦР в формате FLASH (Fluorescent Amplification-based Specific Hybridization) (Лаптинов, 2004) или в формате реального времени (Norman et al., 2002). Оба формата основаны на флуоресцентной детекции продуктов амплификации. Оба формата позволяют регистрировать результаты ПЦР непосредственно во время (ПЦР в формате реального времени) или после проведения реакции (ПЦР в формате FLASH), без открывания пробирок, благодаря чему решается проблема контаминации помещения продуктами ПЦР, упрощаются требования к организации ПЦР-лаборатории, значительно снижается трудоемкость и время проведения стадии детекции. Методы обеспечивают также возможность простой и эффективной документации и хранения результатов ПЦР в компьютерной базе данных. Следует отметить, что ПЦР в формате реального времени требует довольно дорогого оборудования, тогда как стоимость оборудования для ПНР в формате FLASH сопоставима с оборудованием для гель-электрофореза и в 5 - 8 раз дешевле оборудования для ПНР в реальном времени.
Другим примером применения молекулярных методов для диагностики фитопатогенов, основанных на ПНР и включающих гибридизацию, является весьма перспективный, но пока только развивающийся метод биочипов (Schultz, 1996). Преимущества использования биочипов состоят в следующем: биочип дает возможность проведения множественного параллельного исследования биологических объектов (тысячи ячеек на 1 см2); он миниатюрен, что обеспечивает удобство эксплуатации, экономию реактивов и т. д.; биочип универсален и дешев, так как одна технологическая схема обеспечивает производство различных микрочипов; в биочипе можно использовать в качестве иммобилизованных зондов
На правах рекламы
Разработка программы защиты картофеля от фитофтороза и альтернариоза
Правильно составленная программа обработок фунгицидами для защиты картофеля от фитофтороза и альтернариоза - основа получения высококачественного урожая картофеля. Особенно важны первые обработки, так как ошибки, допущенные в это время, очень трудно исправить последующими обработками. Первые полевые обработки должны обеспечить: защиту поверхности растений картофеля от внешней инфекции (попадающих на стебель и листья зооспор); уничтожение источников заражения на поверхности почвы; лечебное действие в растениях против внутренней скрытой (как правило, стеблевой) инфекции.
Особенно важна защита растений картофеля от стеблевого фитофтороза, который имеет более продолжительный инкубационный период (до 10 и более дней) между инфицированием и появлением первых видимых симптомов, а пораженные стебли, в отличие от листьев, могут спорулировать более длительное время.
Выбор фунгицида для первых обработок
Существующие в настоящее время препараты не позволяют полностью вылечить растения после появления видимых симптомов фитофтороза. Поэтому первые обработки должны быть профилактическими и проведены до инфицирования (максимум в течение 1 - 2 дней после инфицирования), обязательно до появления видимых симптомов.
Применение только контактных препаратов для первых обработок не обеспечивает лечебного действия внутри растений (т. е. если есть внутренняя скрытая инфекция, которая, как правило, заносится с семенным материалом, она получает еще 10-12 дней для развития до следующей обработки). Полностью системные препараты применять опасно ввиду наличия устойчивых штаммов возбудителя фитофтороза. Кроме того полностью системные препараты рекомендуется полностью исключить на семенных посадках картофеля.
Из всех фунгицидов ТАНОС® наиболее подходит для первых двух обработок. Контактный компонент ТАНОСА® - фамоксадон - один из самых мощных известных фунгицидов против фитофтороза и альтернариоза. После обработки он создает защитный экран на поверхности обработанных растений уничтожая зооспоры. При этом он обладает уникальной устойчивостью к смыву - это чрезвычайно важно в дождливых условиях и на поливных участках.
Локально-системный компонент ТАНОСА® одновременно «промывает» ткани растения и обеспечивает лечебное действие против скрытой инфекции. ТАНОС® - один из самых мощных фунгицидов против скрытой/ стеблевой инфекции.
При этом высокая концентрация ТАНОСА® в обработанных растениях гарантирует его стабильную эффективность. Устойчивые к цимоксанилу, а значит и ТАНОСУ® формы фитофтороза отсутствуют.
Начало первых обработок обычно совпадает со временем последнего срока обработки гербицидом ТИТУС® (при высоте растений до 20 см), обязательно до смыкания рядков. В настоящее время для обеспечения гарантированной защиты все чаще первые обработки проводятся раньше при высоте картофеля 5 - 10 см, особенно на чипсовом и семенном картофеле.
фрагменты ДЫК, РНК, белков (с сохранением ферментативных и антигенных свойств), а также клеток - биосенсоров.
Резюмируя вышесказанное, следует отметить, что современные, доступные для широкого круга потенциальных потребителей технологии диагностики и идентификации фитопатогенов базируются, в основном, на двух технологиях - ИФА и ПЦР, которые постоянно совершенствуются в плане чувствительности, надежности и простоты применения. Кроме того, в настоящее время существует тенденция использования комплекса методов (ring tests), включающих как традиционные (микроскопия, избирательные среды, патогенность и т.п.), так и современные серологические и молекулярные тесты. Диагностика фитопатогенов, как собственно и любых других объектов, приобретает черты динамичной и постоянно эволюционирующей системы.
Еще по теме Методы молекулярной диагностики болезней картофеля:
- ЗНАЧЕНИЕ НОВЫХ МЕТОДОВ ДИАГНОСТИКИ ВИРУСНЫХ БОЛЕЗНЕЙ
- ПРИЛОЖЕНИЯ РАСПРОСТРАНЕНИЕ И ВРЕДОНОСНОСТЬ БОЛЕЗНЕЙ И ВРЕДИТЕЛЕЙ КАРТОФЕЛЯ В РАЗРЕЗЕ ЗОН 124 КРАТКИЙ ОПРЕДЕЛИТЕЛЬ НАИБОЛЕЕ ЧАСТО ВСТРЕЧАЮЩИХСЯ БОЛЕЗНЕЙ И ПОВРЕЖДЕНИЙ КАРТОФЕЛЯ ПО ВНЕТТТНЛ11 ЙР ЗЗНАКАМ 126 МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ РАБОТЕ С ЯДОХИМИКАТАМИ 135
- МЕТОДЫ ДИАГНОСТИКИ И МЕРЫ БОРЬБЫ С ВИРУСНЫМИ И МИКОПЛАЗМЕННЫМИ БОЛЕЗНЯМИ, ПЕРЕНОСЧИКИ ВИРУСОВ И МИКОПЛАЗМ
- Б. В. Анисимов. Защита картофеля от болезней, вредителей и сорняков., 2009
- ГЕЛЬМИНТОЛАРВОСКОПИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ
- МЕРЫ БОРЬБЫ С ВИРУСНЫМИ И МИКОПЛАЗМЕННЫМИ БОЛЕЗНЯМИ КАРТОФЕЛ
- 1.5. Методы диагностики Malassezia-инфекций животных
- 1.5.2. Цитологические и культуральные методы диагностики Malassezia-инфекций
- Воловик А. С. и Шмыгля В. А.. Болезни и вредители картофеля. М., Россельхозиздат,., 1974
- И. П. Кондрахин. Методы ветеринарной клинической лабораторной диагностики: Справочник — М.: Колос,. — 520 с., 2004
- КРАТКИЙ ОПРЕДЕЛИТЕЛЬ НАИБОЛЕЕ ЧАСТО ВСТРЕЧАЮЩИХСЯ БОЛЕЗНЕЙ И ПОВРЕЖДЕНИЙ КАРТОФЕЛЯ ПО ВНЕШНИМ ПРИЗНАКАМ О ПОЛЬЗОВАНИИ ОПРЕДЕЛИТЕЛЕ
- Н. И. Архипов, С. Ф. Чевелев, Г. И. Брагин и др.. Патологоанатомическая диагностика вирусных болезней животных: Справочное издание; Под ред. Н. И. Архипова. — М.: Колос,.— 176 с., ил., 1984
- Молекулярная биофизика
- Глава 23. МОЛЕКУЛЯРНАЯ БИОЛОГИЯ
- ОБРАЗОВАНИЕ И ОКИСЛЕНИЕ МОЛЕКУЛЯРНОГО ВОДОРОДА
- 4. Молекулярный ламаркизм и иммунология
- 8.5.2. Проявление старения на молекулярном, субклеточном и клеточном уровнях
- Связь классической и молекулярной генетики
- Глава 24. МОЛЕКУЛЯРНАЯ ГЕНЕТИКА
- 4.1. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ НАСЛЕДСТВЕННОСТИ И ИЗМЕНЧИВОСТИ У ЧЕЛОВЕКА