ВЫЯВЛЕНИЕ МИКРООРГАНИЗМОВ, УЧАСТВУЮЩИХ В КРУГОВОРОТЕ УГЛЕРОДА
Разложение крахмала. Для выделения микроорганизмов, гидролизующих крахмал, производят посев из почвенной суспензии на агар с 1% растворимого или оклейстеризованного крахмала в чашках Петри.
Вокруг колоний микроорганизмов, способных гидролизовать крахмал, образуются прозрачные ореолы.Положив комочки почвы на агар, можно обнаружить микроорганизмы, разлагающие крахмал в почве.
Если чашки залить раствором йода, то среда окрасится в синий цвет. Зоны вокруг колоний окрасятся либо в красно-бурый цвет — гидролиз дошел до стадии декстринов, либо они останутся бесцветными — гидролиз прошел до стадии образования сахара. Наилучшие результаты в опытах по разложению крахмала получаются при работе с растворимым крахмалом.
Разложение пектина. Пектинразлагающие микроорганизмы обладают ферментами-пекгиназами, действие которых на растительную ткань проявляется в размягчении и распаде на отдельные клетки — мацерации растительной ткани. Отбор культур микроорганизмов, обладающих пектиназами, проводят по их мацерирующей способности. Культуры микроорганизмов выращивают в картофельном отваре (200 .г тертого картофеля в 1 л воды кипятят 15 мин, затем фильтруют через марлю и стерилизуют) в течение 10 дней при 24°. Затем куль-
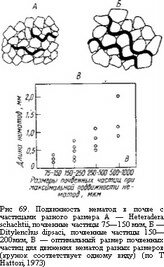 б Б\иолог-ия почв
б Б\иолог-ия почв
туральную жидкость в объеме 20—25 мл выливают в чашки Петри,, в них опускают тонкие срезы картофеля. Мацерацию картофеля определяют" после 6-часового выдерживания в термостате при 40° с помощью тонкой иглы. При наличии мацерации клетки отделяются друг от друга, и срез картофеля размягчается. Мацерация свидетельствует присутствии в культуральной жидкости пектолитических ферментов, в частности протопектиназы.
Присутствие пектолитических ферментов в культурах микроорганизмов можно выявить и по наличию зон осветления и разложения пектина в местах инокуляции микроорганизмов на плотных средах, покрытых слоем 2%-ного растворимого пектина.
В качестве плотной, питательной среды может быть использован почвенный агар.Обнаружение пектинэстеразы проводят в помощью посева на специальную среду следующего состава: картофельный бульон — 1000 мл, пектин — 7 г; дрожжевой автолизат — 5 мл; тиогликолевая кислота — 1 мл; 0,5%-ный бромтимоловый синий — 1 мл. Среду стерилизуют при 0,5 атм 30 мин. После стерилизации pH среды доводят до 7,2—7,5 стерильной 10%-ной NaOH. Инкубацию посевов производят при 37°. На 1, 2, 3 и 4-е сутки роста определяют изменение значения pH по исчезновению окраски индикатора.
Наличие полигалактуроназы в культурах микроорганизмов выявляют, высевая культуры на среду следующего состава: картофельный бульон — 1000 мл; пектин — 13 г; дрожжевой автолизат — 5 мл; тиогликолевая кислота — 0,5 мл; 0,004%-ный нейтральный красный — мл. Последующие операции аналогичны определению пектинэстеразы.
Разложение целлюлозы. Для выделения из почвы, подстилки, торфов и других природных субстратов целлюлозоразлагающих микроорганизмов существует ряд методов.
Аэробное разложение целлюлозы. Аэробные целлюлозоразлагающие микроорганизмы наиболее полно выявляются с помощью метода почвенных пластинок. Почву обогащают соединениями калия и азота (2 мл 1,5%-ного раствора KN03 на 50—60 г почвы). Обогащенную навеску размешивают, увлажняют и помещают в чашку Петри, на дно которой предварительно кладут стерильные обеззоленные фильтры или фильтровальную бумагу. На поверхность почвенной пластинки также накладывают кружок фильтровальной бумаги и плотно прижимают его к поверхности пластинки. Чашки с пластинками инкубируют во влажной камере. Срок инкубации варьирует в зависимости от свойств почвы. Для дерново-подзолистой почвы этот срок можно ограничить несколькими неделями, для чернозема срок инкубации может быть увеличен. Результаты опыта определяют по степени и характеру разложения бумаги. В дерново-подзолистой почве целлюлозоразлагающие микроорганизмы представлены обычно грибами, в черноземе — мик- собактериями.
Используется также метод накопительных культур. В этом случае* применяют среду Гетчинсона (г/л): КН2Р04— 1,0, NaCl — 0,1, СаС12— 0,1, FeCl3 — 0,1, MgS04-7H20— 0,3, NaN03 —2,5, дистиллированная вода. Среду наливают в колбочки или пробирки, куда в качестве ис~
точника углерода помещают фильтровальную бумагу (рис. 65). После стерилизации засевают комочками почвы.
Условия накопительной культуры для целлюлозоразлагающих микроорганизмов можно создать, используя метод комочков. На поверхность пластинок кремнекислого геля или голодного агара накла- дывают кружки фильтровальной бумаги, смоченные раствором Гетчинсона. Затем на поверхность бумаги раскладывают 25 комочков почвы. Чашки инкубируют в термостате при 25—30° во влажной камере и наблюдают за развитием микроорганизмов.
 Через несколько недель подсчитывают процент комочков, вокруг которых наблюдается разложение клетчатки, и составляют характеристику развивающихся микроорганизмов на основе их микроскопического исследования.
Через несколько недель подсчитывают процент комочков, вокруг которых наблюдается разложение клетчатки, и составляют характеристику развивающихся микроорганизмов на основе их микроскопического исследования.
Последний метод может быть использован для количественного определения целлюлозоразлагающих микроорганизмов в почве.
Анаэробное разложение целлюлозы. Для накопительной культуры анаэробных целлюлозоразлагающих микроорганизмов А. А. Имше- нецкий предложил следующие питательные среды. Для накопительной культуры (г/л):
NaNH4HP04 • 4Н20 — 1,5, КН2Р04 — 0,5,
К2НР04 — 0,5, MgS04 — 0,4, NaCl — 0,1,
MnS04 и FeS04 — 1 капля 1%-ного раствора, пептон 5,0, СаС03 — 2,0, фильтровальная бумага — 15,0, pH — 7,0 — 7,4.
Для накопительных и чистых культур: мя- со-пептонный бульон — 500 мл, СаС03 — 2 г, фильтровальная бумага — 15 г, водопроводная вода — 0,5 л.
Жидкие питательные среды разливают высоким слоем в высокие пробирки. Фильтровальную бумагу нарезают полосками и опускают на дно пробирки; засевают комочками почвы или навоза и инкубируют в термостате при температуре 30—35° в случае обнаружения мезо- фильных бактерий и при 60° — при поиске термофильных бактерий.
Количественный учет анаэробных целлюлозоразлагающих бактерий проводят методом предельных разведений. Посев производят в несколько параллельных пробирок (не менее 5), которые инкубируют в термостате, просматривают, материалы учета обрабатывают по таблице Мак-Креди. Полученные данные могут, однако, рассматриваться лишь как приблизительные, потому что бактерии трудно смываются с волокон клетчатки, на которых происходит их развитие, и не распределяются равномерно в воде при приготовлении разведений.
При приготовлении препаратов для микроскопирования кусочки разложившейся клетчатки помещают на предметное стекло в каплю воды, разрывают волокна препаровальными иглами, распределяют на стекле, фиксируют и окрашивают.
Образование и окисление метана. Минеральный состав среды для выявления метанобразующих бактерий в почве следующий: NH4C1 — 0,75, КН2РО4— 1Д К2НРО4 — 2,0, MgCl2-6H20 — 0,02, СоС12*6Н20 — 0,01, NaHC03— 2,0, CaC03 — 2,0, выщелоченный агар — 12, вода водопроводная — 100 мл, вода дистиллированная — 900 мл.
Сульфаты в среду не вводят, чтобы препятствовать развитию суль- фатредуцирующих бактерий. Перед посевом в среду добавляют 1 — 2 мл/л дрожжевого экстракта и 20 мл/л стерилизованной культуральной жидкости, полученной при развитии накопительной культуры метаносарцины. Для снижения окислительно-восстановительного потенциала среду кипятят, продувают углекислотой и вносят 4 мл/л 3%-ного раствора Na2S*9H20 в 0,5-ном растворе Na2C03, что соответствует 17 мг/л H2S; pH 7; гН2 около 12. Перед посевом в расплавленную среду вносят источники энергии — кальциевые соли муравьиной, уксусной, молочной кислот или спирты (этанол, метанол) в количестве 1 %.
Существует метод выделения метанобразующих бактерий, в котором в качестве источника энергии используют молекулярный водород. Для засева берут разведения почвенной суспензии в стерильной воде, содержащей 10—20 мг/л H2S. Посевной материал (1 мл) вносят в стерильную пробирку, затем заливают приготовленную среду так, чтобы не оставалось пузырьков воздуха.
Время инкубации при 28—30° составляет от 10 дней до нескольких месяцев. О развитии метанообразующих бактерий судят по выделению пузырьков газа. Однако газообразование не может служить единственным критерием развития метаногенных бактерий. Для подтверждения присутствия бактерий, образующих метан, необходим газовый анализ. Количественный учет метанобразующих бактерий может быть проведен с помощью метода предельных разведений.Для получения накопительных культур метанокисляющих бактерий 1Инокулируют жидкие и агаризованные среды почвенными суспензиями и помещают их в метано-воздушную среду при соответствующей температуре (30, 37, 45, 55, 60°С). Если необходимо выявить весь видовой состав метанокисляющих бактерий, содержащихся в исследуемом образце, то на первом этапе накопительную культуру следует получать на твердой среде. Последующие этапы выделения накопительной культуры необходимо проводить на жидкой среде следующего состава (г/л): KN03 — 1, КН2Р04 — 0,4, К2НРО4 — 0,4, NaCl — 0,3, MgS04-7H20 — 0,3, СаС12 —0,02, FeCl3 — 0,001. Для приготовле- пня сред используют водопроводную кипяченую фильтровальную и дистиллированную воду 1:1. Фосфорные соли растворяют в дистиллированной воде. Для приготовления твердых сред пользуются очищенным агаром «Дифко» или силикагелем. Посуду очищают от органических примесей. В качестве источника углерода в среде используют метан. Опыты проводят в колбе, снабженной двумя стеклянными трубками с кранами и резиновой пробкой. В одну из трубок под давлением зводят метан, второй кран в это время открыт для выхода воздуха. Закрывают оба крана, колбу оставляют на 3—4 дня при 30—37°. На поверхности жидкости появляется красноватая пленка метановых бактерий.
Для выращивания метанокисляющих бактерий на твердых средах используют хроматографические сосуды, которые герметизируют при помощи металлической крышки, оборудованной двумя штуцерами, через них вводится и выводится газовая смесь. В сосуды помещают чашки с агаризованной средой указанного состава, инокулированные почвенной суспензией, и заполняют газовой смесью метан: воздух (1:1 или 1:4). Смену газовой фазы в сосуде осуществляют каждые двое суток. Сосуды помещают в термостат. Спустя 5—10 сут на агаре появляются визуально различимые колонии метанокисляющих бактерий.
Колонии метанокисляющих бактерий получают также при использовании мембранных фильтров. Для этого на агаризованную. среду накладывают фильтры, через которые была предварительно отфильтрована исследуемая проба.
Еще по теме ВЫЯВЛЕНИЕ МИКРООРГАНИЗМОВ, УЧАСТВУЮЩИХ В КРУГОВОРОТЕ УГЛЕРОДА:
- ОБНАРУЖЕНИЕ И УЧЕТ МИКРООРГАНИЗМОВ, УЧАСТВУЮЩИХ В КРУГОВОРОТЕ АЗОТА
- ОБНАРУЖЕНИЕ МИКРООРГАНИЗМОВ, УЧАСТВУЮЩИХ В ПРЕВРАЩЕНИЯХ ФОСФОРА, СЕРЫ, ЖЕЛЕЗА И МАРГАНЦА
- РОЛЬ БОЛОТ В КРУГОВОРОТЕ УГЛЕРОДА
- Биомасса, продуктивность, глобальный круговорот углерода Запасы биомассы
- ЦИКЛ УГЛЕРОДА
- Захороненный углерод и его мобилизация
- ЗАХОРОНЕННЫЙ УГЛЕРОД И ЕГО МОБИЛИЗАЦИЯ
- ГРУППЫ ПЧЕЛ, УЧАСТВУЮЩИЕ В СБОРЕ И ПЕРЕРАБОТКЕ НЕКТАРА
- Выявление фальсификации пищевых продуктов.
- 1* Выявление презумпций. “Бритва Оккама”
- 9.4. Изменчивость поведения и выявление роли генотипа
- Методы выявления резистентности гельминтов к антигельминтикам
- УГЛЕРОД
- 3. 2. Биотический круговорот