О «ГЕНЕТИЧЕСКОМ КОНТРОЛЕ» НАД ДИФФЕРЕНЦИАЦИЕЙ КЛЕТОК И ТКАНЕЙ
Большое количество фактов в эмбриологии и генетике, касающихся роли ядра цитоплазмы не поддается еще объяснению. Все явления эмбрионального развития генотипически обусловлены, но обычно не анализируется участие генов в нормальном эмбриональном развитии, включая гаструляцию и развитие органов. Это можно видеть и по настоящей книге, в которой дается анализ процессов дробления,- гаструляции и других без упоминания о генетической обусловленности всех явлений и используются различные факты, касающиеся, например, количества и расположения желтка и т. п. Это происходит, с одной стороны, потому, что эмбриология пока почти не располагает генетическими и цитогенетическими данными, касающимися механизма развития. С другой стороны, экспериментальная эмбриология располагает большим количеством фактов, которые как будто исключают «контроль» хромосом и генов в развитии.
Поскольку возможно нормальное развитие при партеногенезе, наличие отцовских генов необязательно для всех процессов развития, за исключением тех признаков, которые могут быть обусловлены генами сперматозоида. Но и хромосомы матери также не необходимы для основных процессов развития. Об этом говорит возможность получения андрогенеттеских Зародышей, т. е. зародышей, развивающихся из яйца с ядром исключительно отцовского происхождения. Так, Б. А. Астауров и В. П. Острякова-Вар- шавер в 1957 г. убивали ядро яйца тутового шелкопряда одного вида; яйцо оплодотворялось затем сперматозоидами другого вида. Так как у этих видов возможна полиспермия, то удалось добиться слияния ядер двух сперматозоидов, в результате чего осуществляется диплоидный гетероспермный андрогенез. Происходит нормальное развитие.
Некоторые исследователи (например, Ж. Браше, Ю. А. Филиппенко и др., 1929) считали, что существует наследственность, контролирующая ранние стадии развития (обусловленная и ядром и цитоплазмой), и наследственность менделевского типа, обусловленная ядром. Некоторые эмбриологи высказывают мысль, что гены не участвуют в образовании основных органов зародыша, а контролируют последние этапы дифференциации. Так, с этой точки зрения цвет глаз находится под контролем генов, а развитие самого глаза происходит без участия генов. В качестве агру- ментов для обоснования этой точки зрения могут быть использованы многие факты. В гл. XI говорилось о роли области серого серпа в развитии амфибий. Если оставить неповрежденным ядро яйцеклетки, но локально разрушить серый серп, резко нарушается дифференцировка хорды и нервной системы. Можно экспериментально, по желанию, устанавливать плоскость симметрии у яиц амфибий, вызывать появление серого серпа в желаемом месте.
Возможно (хотя и уродливое) дробление при полном отсутствии ядра, что впервые наблюдала Е. Гарвей в 1936 г. Это сообщение было встречено резким скептицизмом эмбриологов, но впоследствии, однако, оно полностью подтвердилось.
Э. Вильсон (1896) сдавливал оплодотворенные яйца Nereis между двумя стеклянными пластинками, при этом первые, три деления происходили в меридиональном направлении. Зародыш оказывался в виде пластинки из восьми клеток. Затем давление ослаблялось, дробление продолжалось, зародыш теперь состоял из восьми микромеров и восьми макромеров. В дальнейшем развивалась. свободноплавающая личинка, у которой зачаток кишки состоял не из четырех, а из восьми макромеров. Четыре ядра макромеров первого квартета (из них развивается апикальный орган и прототрок) в указанных экспериментальных условиях становятся ядрами -энтобластов. Вильсон еще в конце прошлого века заключил, что у полихет дифференциация клеток зависит не от ядра, а от особенностей цитоплазмы.
Дробление в отсутствие ядра у амфибий отмечалось многими авторами. Е. Штауфер в 1945 г. разрушал мужские и женские пронуклеусы в яйцах аксолотлей. В таких опытах отмечен случай развития почти нормальной безъядерной бластулы.
С другой стороны, имеется ряд достоверных фактов о несомненном участии генов на ранних этапах развития зародышей. Д. Ф. Паульсон в 1940, 1945 гг. обнаружил, что в результате полной утраты Х-хромосомы происходит нарушение ранних стадий развития дрозофиллы (изменяется продвижение ядер к периферии, уродливо развивается бластодерма). Потеря отдельных участков хромосом может повлечь уродливое развитие нервной системы, кишечника, производных мезодермы.
Уже говорилось об ошибочности представлений многих молекулярных биологов и генетиков о половых клетках, как, якобы, недифференцированных. Эмбриологи не имеют оснований поддерживать эту устаревшую точку зрения. Причина сохранения старого взгляда на структуру и функции яйца и спермия заключаются в излишне прямолинейном, хотя и увлекательном представлении многих исследователей, согласно которому все морфогенетические процессы эмбрионального развития обусловлены системой геномных переключений. Излишне оптимистически думают, что для понимания того, как происходит дифференциация, нужно узнать только, когда и какие гены активируются. Однако все факты, касающиеся ранних этапов эмбрионального развития, заставляют утверждать, что система генетических переключений не может играть решающую роль в ранних стадиях эмбрионального развития.
Выражаясь генетическим и молекулярно-биологическим языком, вся информация, необходимая для ранних стадий развития, содержится в цитоплазме яйца еще до оплодотворения. Когда в развитии появляются новые генетические «указания», определяющие дифференцировку и развитие, при теперешних возможностях эмбрио-генетического анализа мыслимо узнать лишь путем определения времени появления новых «инструкций» от аппарата наследственности сперматозоида. Молекулярная биология располагает достаточно точными методами определения ферментов. Доказано, что отцовские ферменты появляются на сравнительно поздних стадиях развития: у амфибий — после того как у зародыша начинается сердцебиение и мышечные сокращения. Ферменты, участвующие в изменении оболочки яйца морского ежа, имеют материнское происхождение и т. д. Общий вывод бесспорен: на ранних этапах развития дифференциация осуществляется не путем включения транскрипции, а за счет генетико-эмбриологической программы, имеющейся уже в цитоплазме яйца.
В настоящее время в области молекулярной биологии интенсивно разрабатываются вопросы, касающиеся установления времени начала синтезирования и функционирования тех или иных видов РНК и белков (ферментов). Было показано, что в ооплазме содержится все необходимое для ранних этапов развития, т. е. материнский геном обеспечивает запас необходимых строительных материалов и энергии для осуществления дробления. Выявлены и изучены разнообразные мутации, влияющие на процессы раннего развития.
Можно сделать вывод: на ранних стадиях развития все сложные морфогенетические процессы (дробление, формирование бластулы, а в некоторых случаях и формирование ранней гастру- лы) происходят на фоне слабой активности генома зародыша.
Установлено, что все изменения в функционировании генома бластомеров и клеток более поздних зародышей зависят от взаимодействия ядер с цитоплазмой. Распределение качественно различных участков цитоплазмы, как уже отмечалось ранее, зависит от проморфологии зиготы и от сегрегации цитоплазмы. В этом смысле можно говорить, что программа ранних периодов развития определяется проморфологией зиготы и связанной с ней сегрегацией цитоплазмы. К сожалению, мало исследований цитогенетического и генетико-эмбриологического характера по вопросам роли разных структур сперматозоида в начальных этапах эмбрионального развития. Естественно, все внимание в нашем столетии сосредоточивалось на изучении роли ядра. Однако имеется много косвенных данных, позволяющих решать вопросы — принадлежит ли ядру и другим структурам сперматозоида роль, так или иначе дополняющая роль яйцеклетки в развитии. Л. Д. Удалова (1975) установила, что у ранних зародышей крыс, отцы которых подвергались действию рентгеновского облучения, наблюдаются разного рода хромосомные аберрации. Есть основания полагать, что отцовская наследственность у млекопитающих важна для нормального развития трофобласта и последующего контакта со стенкой матки (развития плаценты). Это обстоятельство многие авторы связывают с неудачами получения поздних стадий партеногенетически развивающихся зародышей.
Обнаружено, что раковины некоторых моллюсков (Limnaea) обычно закручены в правую (декстральную) спираль, но изредка попадаются особи с раковиной, завернутой влево (синистральный завиток). Доказано действие генов на очень ранних стадиях развития. Направление завитка раковин коррелировано с направgt; лением наклона веретена митоза при третьем дроблении. Это направление веретена предопределяется до оплодотворения влиянием организма матери на еще незрелое яйцо в яичнике. Отцовский ген направления завитка, привносимый сперматозоидом, не изменяет характера завитка раковины, обусловленного материнской наследственностью. Фенотипическое проявление генетически обусловленного направления завитка раковины зависит не от генотипа самой особи, а от генотипа ее матери. Этому демонстративному примеру материнской наследственности дан вполне удовлетворительный генетический анализ и выяснено, почему в природе наблюдаются определенные числовые отношения— редкие случаи особей с синистральными завитками по сравнению с декстральными. Ген декстрального направления доминирует над геном синистрального.
Для обрисовки трудностей, встающих перед генетикой и эмбриологией, следует возвратиться к тому диалектическому противоречию, о котором говорилось в гл. XI: бластомеры вследствие механизма митоза равнонаследственны, и в то же время с самого начала развития происходит дифференциация. Нет ни одного факта в эмбриологии, подтверждающего теорию Вейсмана, согласно которой хромосомы в разных бластомерах содержат качественно неодинаковые «детерминанты» (гены), которые ответственны за дифференциацию. Речь может идти лишь о различном функционировании генома.
Заслуживают внимания идеи А. А. Заварзина, который отмечал, что в связи с бурным развитием генетики и установлением непосредственной связи генов с хромосомами изучение ядерных структур свелось преимущественно к изучению этих структур в половых клетках. Поэтому кариология в значительной степени сводится к цитогенетике.
Некоторые исследователи, не зная статьи А. А. Заварзина, высказали родственные мысли и сделали попытки экспериментальных доказательств их правильности. Г. Штерн, В. Олфрей, А. Мирский и Г. Ситрен в 1952 г. установили, что ядра разных тканей отличаются друг от друга по содержанию в них ферментов.
Ц. Паван в 1955 г. и другие исследователи изучали тонкую структуру политенных хромосом личинок насекомых (типа гигантских хромосом клеток слюнных желез). В гигантских или политенных хромосомах в результате эндомитозов происходит многократное (до 1000 раз) удвоение хроматид хромосом, без их расхождения, в связи с чем деспирализованная хромосома утолщается, так как наращиваются все новые и новые хромати- ды. Длина гигантских хромосом превышает' обычные метафазные хромосомы в 100—250 раз. Последовательность дисков одинакова, однако наблюдаются закономерные особенности в «набухании» [13]
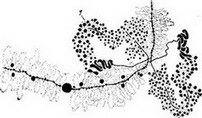
Рис. 120. Левый конец хромосомы XII ооцита Triturus crista- tus. Имеется много нормальных пар петель ламповых щеток и одна пара гигантских петель (1) (по И. С. Галлу, X. Г. Кал- лаку, 1962)
разных участков хромосом, в образовании и развитии «пуфов»— «вздутых» участков. В различных тканях или на разных стадиях развития одной и той же ткани признаки активности проявляют разные локусы хромосом; при этом морфологические изменения хромосом строго закономерно совпадают с определенными периодами в развитии тканей. Это установлено при изучении развития слюнной железы. Когда период активности заканчивается, вздувшийся участок почти полностью возвращается в свое исходное состояние.
Интересны наблюдения, проведенные X. Калланом в 1960 г. над гигантскими хромосомами типа «ламповых щеток», которые обнаруживаются в ядрах ооцитов рыб, амфибий, птиц и других позвоночных и у некоторых беспозвоночных (рис. 120).
От хромомер хромосом в сторону от оси отходит пара или несколько петель разной величины — от гигантских до очень небольших. Вероятно, эти петли содержат белок и участки непрерывной ДНК. Предполагают, что петли эти — продукт деятельности генов и что в разных локусах хромосом проявляется разная активность. Действительно, в соответствующих локусах гомологичных хромосом чаще всего петли имеют одинаковую форму, но есть и гомологичные локусы с петлями различной формы, что объясняют гетерозиготностью, непосредственно проявляющейся в самих хромосомах. Такое объяснение подтверждается результатами опытов по скрещиванию.
В последнее время усиливается интерес к вопросам «функцио- . нальной организации» хромосом, и, в частности к активным участкам хромосом — к пуфам, о которых говорилось ранее и с которыми многие исследователи связывают дифференциацию
клеток и тканей. Пуфы рассматриваются• как участки локальной деспирализации хромосом, обеспечивающей в сочетании с биохимическими механизмами переход генов, локализированных в них, в активное состояние. Следует поэтому подробнее остановиться на соответствующих цитогенетических и эмбриологических вопросах. Генетика считает, что роль хромосом состоит в «кодировании» и «реализации» «наследственной информации». Этой роли соответствует структура хромосом, а именно строго закономерное расположение внутри хромосомы «наследственного материала». Организация хромосомы должна обеспечивать закономерную редупликацию ДНК. Эти и другие вопросы освещаются в пособиях по генетике и цитогенетике.
И. И. Кикнадзе провела обширные исследования на гигантских хромосомах слюнных желез хирономид (Chironomus dorsalis Meig), а также и на других клетках животных и растений. Эти данные приводятся в дальнейшем. Она утверждает, что в хромосомах слюнных желез функционируют около 220 пуфов, это составляет около 26% от общего числа дисков хромосомы. Пуфы связаны в своем развитии только с дисками политенных хромосом, но не с междисковыми пространствами. Основой для образующегося пуфа является, как правило, единичный диск. Диски могут содержать разное количество ДНК. Могут образовываться и сложные пуфы, в формировании которых принимает участие несколько дисков (рис. 121,Л, Б). Диски хромосом идентичны хромомерам и объединяют комплексы генов, связанных в своем действии. Кикнадзе утверждает, что пуфы являются единственными центрами синтеза РНК в клетке. Пуфы — это специфические дискретные единицы, играющие роль в синтезе РНК и редупликации ДНК. В работе некоторых пуфов отмечается определенная периодичность. Крупные пуфы функционируют непрерывно во всех клетках слюнной железы, они способны к синтезу РНК. Таких пуфов около 80% от общего числа клеток железы, остальные функционируют лишь в части клеток.
Не следует думать, что функционирование основных пуфов в ядрах Ch. dorsalis обязательно связано с локальной редупликацией ДНК в их области, так как оказалось, по данным Кикнадзе, что образование многих крупных пуфов происходит в ядрах, потерявших способность к редупликации ДНК (в клетках пред- куколки и куколки).
Имеет ли место белковый метаболизм в пуфах? Вопрос этот не выяснен, но имеются данные, что количество гистонов в пуфе не меняется при его развитии.
Исследования и гипотезы И. И. Кикнадзе могут служить иллюстрацией состояния спорных вопросов, интересующих эмбриологию, о функционировании хромосом в онтогенезе животного. Считается, что единая хромосомная нить состоит из- хромомер, объединяющих группы генов. Хромомеры, изменяясь структурно
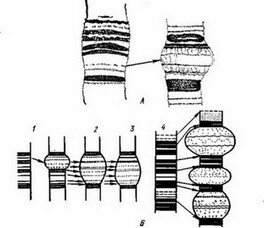
Рис. 121. Формирование пуфов в хромосомах клеток слюнных желез Chironomus dorsalis (по И. И. Кикнадзе, 1967):
А — онтогенез пуфа, 2— 7А3. Пуф. развивается нз одного диска; Б — общая схема возможных путей формирования пуфов; 1 — за счет нескольких дисков (сложный пуф); 2 — за счет тонких и 3 — более крупных дисков с разным количеством ДНК; 4 — «движение» при образовании сложного пуфа
и биохимически, могут быть в активном или в неактивном состоянии. Предполагается, что дифференциация клеток связана с активацией разных частей генома в разных типах клеток.
На ранних этапах дробления яйца хромосомы отличаются от хромосом клеток бластулы и последующих стадий развития. Ядра первых бластомеров очень крупные, хромосомы большой длины, спирализация их слабая. Налицо все признаки высокой активности хромосом, но синтеза рибосомной РНК в это время не происходит. На стадии бластулы в клетках, по данным Кикнадзе, происходит уменьшение ДНК («диминуция»), и хромосомы укорачиваются, так что на стадии 33—64 бластомеров они в 2,5—3 раза короче хромосом первого деления дробления и в 3—4 раза тоньше их. Меняется и структура ядер в периоде между делениями. Эти явления нестабильного состояния ДНК—«материальных носителей наследственности» — трудно объяснить.
Формирование пуфов Кикнадзе обнаружила на разных стадиях метаморфоза личинок Ch. dorsalis. Общее количество пуфов увеличивается в течение четвертого личиночного возраста, но специфических пуфов, характеризующих каждую стадию метаморфоза, немного: четыре — у предкуколки и три — у куколки. С чем связано образование этих пуфов, каково их значение? Эмбриологи могут относиться к высказываниям цитогенетиков лишь как к предположениям, так как не доказана причинная зависимость между формированием пуфов и какими-либо определенными морфофизиологическими явлениями. Кикнадзе считает эти пуфы «эффекторами, регулирующими изменение общей картины функционирования хромосом при смене стадий метаморфоза». Действительно, какая-то связь между формированием пуфов и стадиями метаморфоза есть, но ничего неизвестно о том, что означают эти корреляции. Происходит в ходе метаморфоза изменение соотносительной активности разных пуфов, например, многие слабо- функционирующие у личинок пуфы, у предкуколки и куколки функционируют энергично, часть пуфов, наоборот, прекращает свою деятельность. Кикнадзе утверждает, что изменения картины пуфов в ходе метаморфоза коррелированы с определенными физиологическими процессами в клетках слюнной железы — с усилением синтеза мукополисахаридов, с появлением в цитоплазме белковых гранул.
Интересен, но не поддается объяснению тот факт, что основное количество пуфов, характеризующих геном клеток слюнных желез, является устойчивым в разных популяциях и у мутантных организмов. Доказано влияние на активность хромосом факторов внешней среды, например температуры. Таковы интересные данные исследований Кикнадзе, которые эмбриологи, конечно, берут на учет в своих гипотезах. Однако эмбриология пока не располагает доказательствами того, что причиной тех или иных формообразовательных процессов являются именно возникновение я функционирование пуфов. Это относится и к «ламповым щеткам».
Многие генетики и эмбриологи вынуждены быть пока осторожными в наделении пуфов и ламповых щеток морфогенетическими функциями. Может быть, формирование пуфов — одно из проявлений реагирования клеток на биохимические изменения в клеточных системах, а не причинный момент формообразовательных процессов. Имеются указания (И. Клевер, 1965) на то,, что образование пуфов в клетках слюнных желез можно вызвать различными воздействиями, например изменением соотношения ионов Na+ и К+ в ядре.
Источник: Токин Б. П.. Общая эмбриология: Учеб, для биол. спец, ун-тов.—4-е изд., перераб. и доп. 1987
Еще по теме О «ГЕНЕТИЧЕСКОМ КОНТРОЛЕ» НАД ДИФФЕРЕНЦИАЦИЕЙ КЛЕТОК И ТКАНЕЙ:
- Научный контроль над человеком
- 8.2.7. Генетический контроль развития
- Генетический контроль синтеза белков
- 3.3. ОБЩИЕ СВОЙСТВА ГЕНЕТИЧЕСКОГО МАТЕРИАЛА И УРОВНИ ОРГАНИЗАЦИИ ГЕНЕТИЧЕСКОГО АППАРАТА
- 7.5.3. Образование органов и тканей
- Резорбция из тканей
- Теория дивергентной эволюции тканей
- 15.4. ВНУТРИВИДОВАЯ ДИФФЕРЕНЦИАЦИЯ ЧЕЛОВЕЧЕСТВА
- 8.2.3. Сортировка клеток
- 8.2.4. Гибель клеток
- Функциональная дифференциация организма